Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Реакционная способность ароматических гетероцикловСодержание книги
Поиск на нашем сайте
Ароматические свойства Пиридин по электронному строению напоминает бензол. Все атомы углерода и атом азота находятся в состоянии sp2-гибридизации, и все σ-связи (C-C, C-N и C-H) лежат в одной плоскости (рис. 13.1, а). Из трех гибридных орбиталей атома азота две участвуют в образовании
Рис. 13.1. Пиридиновый атом азота (а), распределение электронов по орбиталям (б) и сопряженная система в молекуле пиридина (в) (связи С-Н для упрощения рисунка опущены) σ-связей с атомами углерода (показаны только оси этих орбиталей), а третья орбиталь содержит неподеленную пару электронов и в образовании связи не участвует. Атом азота с такой электронной конфигурацией называют пиридиновым. За счет электрона, находящегося на негибридизованной р-орбитали (см. рис. 13.1, б), атом азота участвует в образовании единого электронного облака с р -электронами пяти атомов углерода (см. рис. 13.1, в). Таким образом, пиридин является π,π-сопряженной системой и удовлетворяет критериям ароматичности (см. 2.3.2). В результате большей электроотрицательности по сравнению с атомом углерода пиридиновый атом азота понижает электронную плотность на атомах углерода ароматического кольца, поэтому системы с пиридино- вым атомом азота называют π-недостаточными. Кроме пиридина, примером таких систем служит пиримидин, содержащий два пиридиновых атома азота. Пиррол также относится к ароматическим соединениям. Атомы углерода и азота в нем, как и в пиридине, находятся в состоянии sp2-гибридизации. Однако в отличие от пиридина атом азота в пирроле имеет иную электронную конфигурацию (рис. 13.2, а, б).
Рис. 13.2. Пиррольный атом азота (а), распределение электронов по орбиталям (б) и сопряженная система в молекуле пиррола (в) (связи С-Н для упрощения рисунка опущены) На негибридизованной р -орбитали атома азота находится неподеленная пара электронов. Она участвует в сопряжении с р -электрона- ми четырех атомов углерода с образованием единого шестиэлектронного облака (см. рис. 13.2, в). Три sp2-гибридные орбитали образуют три σ-связи - две с атомами углерода, одну с атомом водорода. Атом азота в таком электронном состоянии получил название пиррольного. Шестиэлектронное облако в пирроле благодаря р,п -сопряжению делокализовано на пяти атомах цикла, поэтому пиррол представляет собой π-избыточную систему. В фуране и тиофене ароматический секстет также включает неподеленную пару электронов негибридизованной p-АО кислорода или серы соответственно. В имидазоле и пиразоле два атома азота вносят разный вклад в образование делокализованного электронного облака: пиррольный атом азота поставляет пару и-электронов, а пиридиновый - один p-электрон.
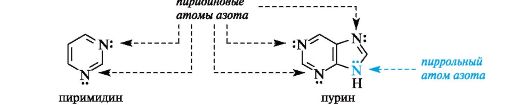
Ароматичностью обладает также пурин, представляющий собой конденсированную систему двух гетероциклов - пиримидина и имидазола.
Делокализованное электронное облако в пурине включает 8 π-электронов двойных связей и неподеленную пару электронов атома N-9. Общее число электронов в сопряжении, равное десяти, соответствует формуле Хюккеля (4n + 2, где п = 2). Гетероциклические ароматические соединения обладают высокой термодинамической устойчивостью. Неудивительно, что именно они служат структурными единицами важнейших биополимеров - нуклеиновых кислот.
|
||||||
|
Последнее изменение этой страницы: 2016-12-16; просмотров: 1081; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.145.12.100 (0.009 с.) |