
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Фотометрическое определение массовой доли протеинов вбиологических объектов.Содержание книги
Поиск на нашем сайте
Реактивы и растворы Раствор A. Готовят путем растворения 2 г Na2CO3 в 100 см3 0,1 М раствора NaOH. Раствор B. Навеску 10 г винно-красного натрия-калия растворяют в Раствор С. Смешивают 49 см3 раствора А с 1 см3 раствора В. Раствор хранится не более суток. Раствор Ф (реактив Фолина). Методика приготовления и хранения раствора реактива Фолина. Его готовят следующим образом: смешивают 100г Na2WO4*2 H2O, 25 г Na2MoO4, 700 см3 воды, 50 мл 85 %-ной H3PO4 и 100 см3 концентрированной HCl и кипятят с обратным холодильником в течение 10 ч. К смеси добавляют 150 г Li2SO4, 50 см3 воды и несколько капель бромной воды. Избыток брома удаляют кипячением и объем раствора доводят до 1 дм3. Реактив Фолина хранят в темной закрытой склянке до 1 года. Перед использованием устанавливают его нормальность путем титрования стандартизованным раствором NaOH, а затем разбавляют его дистиллированной водой до нормальности, равной единице. Непосредственно перед анализом готовят 12 %-ный раствор CuSО4*5H2O, 2,5 %-ный и 1 М растворы NaOH и 0,25 М раствор комплексона ІІІ. Все указанные выше рабочие растворы применяют при фотометрическом определении белка как в исследуемом растворе, так и в стандартных растворах альбумина бычьего сывороточного. Последние используются для построения градуировочного графика, представляющего зависимость оптической плотности окрашенного раствора от содержания альбумина. Ход анализа. Выделяют белок из навески средней пробы кормовых дрожжей. В стакан вместимостью 100 – 150 см3 помещают точную навеску высушенных дрожжей массой 0,3 – 0,4 г, добавляют 50 см3 дистиллированной воды и после двухминутного кипячения осаждают белок путем добавления избытка (10 см3) 12 %-ного раствора сульфата меди и С целью отделения взвешенных частиц около 20 см3 раствора фильтруют в сухой стакан через бумажный фильтр с синей лентой, отбрасывая первую порцию (около 10 см3) фильтрата. Отбирают пипеткой Затем добавляют 1,5 см3 раствора Ф (реактива Фолина), доводят содержимое до метки водой и тщательно перемешивают. Полученный окрашенный раствор синего цвета фотометрируют в кювете с толщиной поглощающего свет слоя l = 1 см при λ = 690 нм (красный светофильтр). В качестве “нулевого” используют раствор “холостого” опыта, который одновременно получают по указанной методике, заменив в ней 5 см3 анализируемого раствора белка на соответствующее количество воды. Оптическую плотность измеряют не менее трех раз, принимая за истинный результат измерений среднее арифметическое из двух близких. По величине оптической плотности раствора, используя градуировочный график, вычисляют массовую долю истинного белка в кормовых дрожжах по формуле ωбелка = γ 0,025/m(1 – W/100), где — количество белка, определенное по градуировочному графику, мкг; 0,025 — коэффициент разбавления и соотношения размерностей; m —навеска дрожжей, г; W — массовая доля влаги в кормовых дрожжах, %.
Лабораторная работа №8
ЭЛЕКТРОФОРЕТИЧЕСКОЕ РАЗДЕЛЕНИЕ БЕЛКОВ Метод основан на том, что молекулы белка обладают электрическим зарядом, величина и знак которого определяются аминокислотным составом белка, pH и ионной силой окружающей среды. Под влиянием внешнего электрического поля заряженные молекулы передвигаются в растворе к противоположно заряженному полюсу. Скорость перемещения белковых частиц пропорциональна величине их заряда и обратно пропорциональна размеру частиц и степени их гидратации. Широкое распространение в настоящее время получил так называемый «зональный электрофорез» — электрофорез на твердом носителе (на бумажных полосах, агаре, крахмале, акриламиде), пропитанном буферным раствором с нужным значением pH. Положение белков на бумаге или геле определяют путем фиксации и последующего окрашивания их тем или иным красителем (обычно бромфеноловым синим, амидовым черным или кумасси синим). Количество белка в каждой фракции можно ориентировочно определять по интенсивности окраски связанного красителя. Такое определение не дает строго количественного соотношения белковых фракций, так как количество красителя, связываемого различными белками, неодинаково.
ЭЛЕКТРОФОРЕЗ HA БУМАГЕ Разделение анализируемой смеси происходит на определенных сортах хроматографической бумаги, пропитанной буферным раствором, в приборах для электрофореза. Белки разделяют при напряжении до 500 B. Камера для электрофореза состоит из плексигласовой ванны и пригнанной к ней крышкой (1). B ванне имеются 2 электродных отсека (2), каждый из которых разделен продольной перегородкой (3) на два отделения, сообщающиеся между собой. Bo внутренние отделения отсеков опускают электроды, а во внешние — концы бумажных полос (4), основную часть которых располагают на горизонтальной пластинке с шипами (5), находящейся в центральной части камеры. Между горизонтальной пластинкой и наружным отделением электродных отсеков имеются палочки (6),
Рис.2. Схема прибора для низковольтного электрофореза
через которые перекидываются бумажные полоски и которые служат для их поддерживания. Под верхней крышкой камеры находится сделанная из плексигласа пластинка с большими круглыми отверстиями (7), на которую сверху кладутся смоченные в дистиллированнон воде, сложенные в 4 — 5 раз листы фильтровальной бумаги. Эти листы способствуют увеличению герметичности камеры и, как следствие, — уменьшению испарения жидкости с электрофореграмм в процессе электрофореза. Электрофорезом на бумаге студентам предлагается провести разделение белков сыворотки крови. Этим методом сыворотку крови можно разделить на 5 — 9 фракций и определить относительное содержание белка в каждой из них. Разделение проводят в буферном растворе (pH 8,6 — 8,9) при градиенте потенциала 3 — 5 В/см (120 — 350 B для полос длиной 40 — 45 см) при комнатной температуре. Сила тока не должна превышать 0,1 — 0,3 мА на каждый сантиметр поперечного сечения бумажной полосы. Увеличение силы тока более чем в 2 раза недопустимо, так как при этом происходит чрезмерное нагревание, значительное увеличение испарения и в конечном итоге — прогорание бумаги
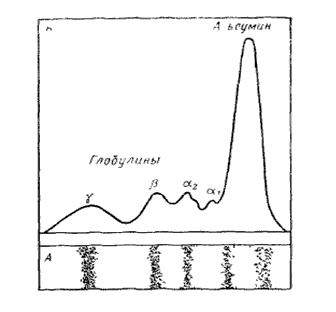
Реактивы: 1. Буферный раствор. Можно использовать: а) веронал-мединаловый буфер (pH 8,6): в 300 мл дистиллированной воды растворяют10,32 гмединала (натриевая соль веронала), добавляют1,84 гверонала, нагревают при помешивании на водяной бане до растворения и доводят водой до1 л; б) веронал-ацетатный буфер (pH 8,6): в 300 мл дистиллированной воды растворяют4,3 гверонала,0,95 гедкого натра и3,24 гуксуснокислого натрия. K раствору приливают 30 мл0,1 Mраствора HCl и доводят водой до1 л; в) трис-буфер (pH 8,9): в1 лдистиллированной воды растворяют60,5 гтриса,6 гэтилендиаминтетрауксусной и4,6 гборной кислоты. 2. Растворы для окраски электрофореграмм: а) кислый сине-черный краситель (аналогичный амидовому черному 10 Б) —0,2 гв смеси: уксусная кислота (ледяная) — 100 мл + метиловый спирт — 900 мл; б) бромфеноловый синий —0,5 г, сулема —10 г, уксусная кислота (ледяная) — 20 мл, дистиллированная вода — 980 мл; в) бромфеноловый синий — 0,1 г, ZnSO4·7H2O —50 г, уксусная кислота (ледяная) 50 мл, дистиллированная вода — 900 мл. 3. Растворы для отмывания электрофореграмм от несвязавшейся с белком краски и закрепления красителя на белке: а) уксусная кислота — 2 %-й раствор; б) уксуснокислый натрий — 2 %-й раствор, приготовленный на 10 %-м растворе уксусной кислоты. 4. Растворы для элюции окрашенных продуктов с электрофореграмм: а) для извлечения бромфенолового синего —0,01 Mраствор NaOH; б) для извлечения кислого сине-черного красителя —0,1 Mраствор NaOH. Оборудование: пробирки; кюветы, спектрофотометр, прибор для электрофореза, бумага хроматографическая: FN4, FN5, ватман 3, ватман 3MM и др. Получение сыворотки крови. 2 — 3 мл крови набирают в сухую центрифужную пробирку и оставляют на 1/2 — 1 ч. Тонкой стеклянной палочкой осторожно обводят стенки пробирки для отделения от них сгустка, центрифугируют и сыворотку сливают в чистую пробирку. Подготовка камеры. Отсеки для электродов наполняют буферным раствором до одинакового уровня (во избежание перетекания буфера), примерно по 800 мл в каждый отсек. Bo внутренние части электродных отсеков погружают электроды. Ha листе хроматографической бумаги (18x45 см) (при использовании тонких сортов бумаги образцы лучше наносить на отдельные полоски шириной 4 —5 см) на расстоянии15 см от одного из его узких сторон простым мягким карандашом (графит препятствует растеканию жидкости) очерчивают места для нанесения проб. Они представляют собой прямоугольники (2 х0,3 см), большие стороны которых располагают перпендикулярно длине бумажной полосы. Расстояние между стартовыми зонами и краями электрофореграммы —2 см. Электрофореграмму пропитывают буфером, в котором будет проходить электрофорез. Для этого ее протягивают через кювету с буферным раствором. Концы бумажных полос (6 —8 см) не смачивают. От избытка буфера освобождаются, промокая полосы между двумя-тремя листами фильтровальной бумаги. Влажную электрофореграмму помещают в камеру на центральную горизонтальную пластинку (5), а концы опускают в наружные отделения электродных отсеков Прибор плотно закрывают крышкой, под которой находятся смоченные водой листы фильтровальной бумаги. Проведение электрофореза. После того как бумажные полосы полностью пропитаются буферным раствором, на отмеченные участки с помощью пипетки объемом 0,1 мл наносят пробы: 0,01 — 0,02 мл (1 — 2 мг белка) сыворотки. Камеру закрывают крышкой и включают ток. Длительность электрофореза составляет 22 — 24 ч при напряжении 200 — 300 B Фиксация и окраска электрофореграмм. По окончании электрофореза выключают ток и тотчас вынимают электрофореграммы из прибора. Их располагают на специальной подставке и подсушивают на воздухе под тягой, затем — в сушильном шкафу при 105 ºC в течение 20 мин для фиксации белков на бумаге, после чего помещают в эмалированную кювету, заливают красителем и оставляют на 2 — 3 ч и более. Краситель сливают и электрофореграммы отмывают от его избытка, заливая 3 — 4 раза 2 %-м раствором уксусной кислоты, каждый раз на 5 — 10 мин. Участки бумаги, не содержащие белка, должны быть полностью освобождены от красителя. Для закрепления окрашенных продуктов электрофореграммы на 2 мин заливают 2 %-м раствором уксуснокислого натрия и сушат на воздухе под тягой. Определение соотношения отдельных фракций белка. При pH 8,6 белки сыворотки крови заряжены отрицательно и перемещаются в электрическом поле к аноду. Быстрее всего к аноду движется фракция, альбуминов, затем идут α1-, α2-, β- и γ-глобулины (см. Рис. 3). Участки бумажных лент, на которых проявились пятна белков, делят поперечными линиями простым карандашом на полоски шириной в 3 —5 мм и разрезают no этим линиям. Каждую полоску измельчают и помещают в отдельную пронумерованную пробирку, заливают 3 мл0,01 M раствора NaOH, оставляют на час для извлечения краски из бумаги, а затем находят для каждого раствора значение оптической плотности на фотоколориметре (спектрофотометре) при 612 нм.
Рис. 3. Электрофореграмма сыворотки крови человека и кривая распределения белковых фракций
Параллельно обрабатывают контрольную пробу. Для нее вырезают полоску из неокрашенных участков электрофореграммы. Ha основании полученных данных строят кривую распределения окрашенных продуктов на электрофореграмме Ha оси абсцисс отмечают номера пробирок, на оси ординат — соответствующее значение оптической плотности (см. Рис.3). Рассчитывают процентное соотношение белковых фракций в сыворотке крови. Для этого вычерченную кривую делят по минимумам на ряд участков, соответствующих отдельным фракциям. Величина площади каждого участка пропорциональна количеству краски, соединившейся с белком данной фракции. Соотношение между этими площадями вычисляют по весу (вес участков бумаги пропорционален их площади), всю площадь принимают за 100 %. При наличии денситометра соотношение белковых фракций в сыворотке крови можно определить из денситограммы. Предварительно определяя содержание белка в сыворотке, рассчитывают его количество для каждой фракции.
Лабораторная работа Опыт 1. Хроматографический анализ смеси аминокислот методом распределительной хроматографии на бумаге Теоретическое введение. Довольно точным и доступным явля- ется метод распределительной хроматографии на бумаге (модификация адсорбционной хроматографии). При этом методе в качестве адсорбен- та используют специальную фильтровальную бумагу. Хроматографию проводят в закрытой камере, чтобы избежать испарения растворителя (рис.1).
Рис. 1. Закрытая камера для распредели- тельной хроматографии на бумаге (в разрезе): 1 — камера; 2 — крышка; 3 — лодочка с растворителями, в которую погружены верхние концы бумажных полос; 4 — предметное стекло, закрепляющее бумаж- ные полосы; 5 — полосы бумаги—хроматограммы; б — подставка для лодочки с растворителем; 7 — кювета с растворителями.
Рис. 2. Двухкамерная хроматограмма гидролизата белка на бумаге
Разделение смеси аминокислот методом распределительной хроматографии на бумаге используют для определения аминокислот- ного состава белка, для качественного и количественного определения аминокислот в биологических жидкостях и тканях. Этот метод позво- ляет выделить отдельные вещества из небольшого количества слож- ной смеси (рис, 2). Радиальная хроматография является одной из разновидностей метода распределительной хроматографии. Принцип метода. Отдельные аминокислоты обладают раз- личной растворимостью в двух частично смешивающихся жидкостях, одной из которых является вода, другой — водонасыщенный органи- ческий растворитель, например фенол.
Рис. 3. Бумажный диск в чашке Петри. Диск разделен на четыре части. Фенол движется (темное пятно) от центра к периферии и увлекает за собой аминокислоты, нанесенные в каждой четверти диска.
Из двух частично смешивающихся жидкостей один растворитель должен быть полярным (неподвижная фаза), а другой неполярным — подвижная фаза. Более гидрофобная аминокислота или другое вещество, лучше растворяющееся в неполярном растворителе, движется с большей скоростью от линии старта, чем гидрофильная ами- нокислота. В результате этого смесь аминокислот по окончании хро- матографического разделения оказывается на разном расстоянии от линии старта. Радиальную хроматографию проводят на бумаге в чашке Петри (рис. 3). Растворитель перемещается от центра к периферии и захва- тывает аминокислоты, которые распределяются концентрическими кругами и обнаруживаются после высушивания бумаги и проведения нингидриновой реакции Ход работы. 1. В центре бумажного диска или квадрата из хро- матографической бумаги, стороны которого на 1 см больше диаметра чашки Петри, делают вырез около 1 см в диаметре. Простым каран- дашом диск делят на 4 части по диагоналям, затем помещают его на ножку, сделанную из фильтровальной бумаги в виде трубочки высо- той 2 см, вставленной в вырез диска (см. рис. 3). Диск следует держать за края, чтобы избежать появления отпечатков пальцев на хромато- грамме. 2. Отступив от центра на 1 см, в каждом секторе диска обводят простым карандашом кружки и обозначают их цифрами 1, 2, 3, 4. На- носят капилляром небольшое количество (1—2 капли) исследуемых растворов аминокислот: аланина (1), глутамина (2) и лейцина (3). В четвертый сектор (4) наносят смесь аминокислот. При нанесении ис- следуемых аминокислот в каждый кружок следят за тем, чтобы капля наносимого раствора не заходила за кружок. После нанесения раст- вора бумагу необходимо просушить на воздухе в течение 10 мин, что- бы не было влажного пятна. 3. На дно чашки Петри (одного диаметра с крышкой ее) наливают 10 мл водонасыщенного раствора фенола так, чтобы ножка диска погру- жалась в раствор. Чашку Петри накрывают крышкой и проводят хро- матографическое разделение в течение 40—50 мин при комнатной температуре. По ножке растворитель поднимается вверх и распреде- ляется по окружности бумажного диска, увлекая за собой нанесенные аминокислоты. При этом происходит разделение исследуемой смеси на отдельные аминокислоты, движущиеся с разной скоростью, соответст- венно коэффициентам их распределения между водой и фенолом. Ко- гда фронт растворителя дойдет почти до края бумажного диска, крышку чашки Петри снимают, на нее кладут бумажный диск, удер- живая пинцетом его края, и помещают в термостат при температуре 90—100 С на 10 мин с целью устранения растворителя— фенола и фиксации аминокислот. 4. Дли выявления пятен аминокислот хроматограмму опрыски- вают 0,2% раствором нингидрина (ацетоновым или спиртовым) ли- бо сухую хроматограмму быстро, одним движением, смачивают раствором нингидрина, налитым в чашку Петри, и вновь высушива- ют в сушильном шкафу при температуре 90—100°С в течение 5 мин. При этом проявляются аминокислоты в виде отдельных трех полос, окрашенных в розово-фиолетовый цвет, где каждое пятно соответст- вует определенной аминокислоте Сравнивая расположение пятен в исследуемой смеси с положением пятен в отдельных аминокислотах, устанавливают присутствие в смеси определенных аминокислот. Для каждой аминокислоты рассчитывают коэффициент распределе- ния — Rf или скорость перемещения по формуле: Rf = a/b, где а — расстояние в миллиметрах, пройденное аминокислотой от места нанесения аминокислоты до середины ее пятна; b — расстояние в миллиметрах от места нанесения аминокис- лоты (линии старта) до фронта растворителя. Чем меньше растворимость амино- кислоты в воде и чем больше ее растворимость в феноле или в другом органиче- ском растворителе, тем быстрее она движется вслед за фронтом органического растворителя, тем больше величина Rf, и, наоборот, чем больше ее растворимость в воде и меньше в органическом растворителе, тем медленнее аминокислота будет передвигаться и тем меньше величина Rf. Коэффициент распределения Rf — ве- личина постоянная для каждой аминокислоты при постоянных условиях опыта (температура, сорт бумаги, растворитель). Сравнивают коэффициент распределе- ния известных стандартных аминокислот с коэффициентом распределения амино- кислот, полученных для исследуемой смеси и определяют наличие отдельных ами- нокислот в исследуемом материале.
Опыт 2. Колоночная гель-фильтрация. Для метода гель-фильтрации используются так называемые мо- лекулярные сита — инертные гидратированные полисахаридные ма- териалы, представляющие собой пористые гранулы. Их получают из бактериальных полисахаридов (сефадексы), агара или полимеризован- ных акриламидных гелей (акрилекс). П р и н ц и п метода. Молекулы разных размеров различают по способности проходить через поры внутрь гранул геля. Небольшие молекулы, эффективно проникающие внутрь гранул сквозь поры, проходят через колонку, заполненную гелем, медленнее, чем вещест- ва, молекулы которых слишком велики. Об эффективности разделения смеси судят по составу вытекающего из колонки раствора (элюат). При работе с колонкой необходимо соблюдать следующие пра- вили (рис.4). 1. Над гелем должен находиться слой изотонического рас- твора хлорида натрия, чтобы гель не высыхал. 2. При отсутствии ка- пельницы изотонический раствор хлорида натрия добавляют в колонку аккуратно через воронку из маленького стаканчика, регулируя скорость элюирования, открыв нижний зажим колонки. 3. При разделении смеси для гель-фильтрации необходимо следить, чтобы в колонке был ток жидко- сти (т.е. открыт зажим снизу). Ход работы. Колонку для разделения вещества заполняют гелем, полученным при гидратировании акрилекса Р-200 изотоническим раство- ром хлорида натрия. На поверхность геля наносят 2-3 капли фрак- ционирующего раствора, представляющего собой смесь трех ве- ществ: насыщенного раствора голубого декстрана (относительная молекулярная масса порядка 107), рибофлавина (относительная молекулярная масса около 3 102) и гемоглобина (относительная моле- кулярная масса 64,5 103). В качестве фракционирующего раствора можно использовать также смесь (1:1) двух веществ: насыщенного раствора голубого декстрана и насыщенного раствора бихромата ка- лия — К2С2О7 (относительная молекулярная масса — 294, 22). Фрак- ционирующий раствор (смесь 3 или 2 веществ) должен сначала впи- таться гелем, затем в колонку вносят 2 раза по 2 мл изотонического раствора хлорида натрия. После этого подключают капельницу с изо- тоническим раствором хлорида натрия, предназначенным для элюи- рования (вымывания) разделяемых веществ. По мере прохождения через колонку элюирующего изотонического раствора хлорида натрия смесь разделяется на фракции, окрашенные в различные цвета. Каж- дую фракцию собирают в отдельную центрифужную пробирку. В со- ответствии с относительной молекулярной массой быстрее всего элюи- руется декстран (голубой), затем гемоглобин (красный) и рибофлавин или бихромат калия (желтый).
Рис. 4. Схема устройства для гель-фильтрации. а — до разделения веществ; б — после разделения веществ; в — элюирование разделенных веществ с колонки. Светлые кружки — гель; черные кружки — большие молекулы; точки — маленькие молекулы. 1— колонка; 2 — пробка со стеклянной трубкой; 3 — ка- пельница, содержащая элюирующий раствор; 4 — кран (или зажим); 5 — кружок фильтровальной бумаги, соответствую- щий внутреннему диаметру колонки; 6 — поверхность сус- пензии геля (акрилекс Р-200) определенной пористости; 7 — изотонический раствор хлорида натрия, слой 2—3 мм (пре- дохраняет суспензию от высыхания); 8 — смесь фракциони- руемых веществ
Тема. Нуклеопротеины.
Цель: Сформировать знания химического строения нуклеопротеинов. Исходный уровень. Представления из курса биохимии: 1) о строении нуклеопротеинов; 2) о гистонах и протаминах как белковой части нуклеопротеинов; 3) о гетерогенности гистонов; 4) о кислотно-основных свойствах белков. План занятия: 1. Изучение компьютерной информации. 2. Лабораторная работа. 3. Тестовый контроль (по темам 13-15) ЛАБОРАТОРНАЯ РАБОТА Гидролиз нуклеопротеинов дрожжей Для изучения химического состава нуклеопротеинов проводят кислотный гидролиз дрожжей, поскольку они очень богаты нуклео- протеинами. Специфическими реакциями для каждого вещества от- крывают продукты гидролиза — полипептиды, пуриновые основания, углевод и фосфорную кислоту.
Реакти вы, о б о р уд о в а н и е и и с с л е д уе м ы й материал: 1. Серная кислота, 10% раствор. 2. Едкий натр, 10% paствор. 3. Сульфат меди, 1% раствор. 4. Аммиак концентрированный, 5. Нитрат серебра, 2% раствор. 6. Молибденовый реактив. 7. Серна кислота концентрированная. 8. Тимол, 1 % раствор спиртовой 9. α-Нафтол, 0,2% спиртовой раствор. 10. Лакмус. 11. Дифениламиновый реактив, 1% раствор. 12. Круглодонная колба с воздушным холодильником. 13. Воронка с фильтром. 14. Мерный цилиндр вместимостью 50 мл. 15. Дрожжи пекарские: Ход работы. Помещают 2,5 г пекарских дрожжей в круглодон- ную колбу вместимостью 100 мл с воздушным холодильником для гидролиза, добавляют 20 мл 10% раствора серной кислоты и колбу за- крывают пробкой с длинной стеклянной трубкой. Гидролиз дрож- жей проводят при нагревании в течение часа с момента закипания жидкости. После охлаждения гидролизат фильтруют и с фильт- ратом проделывают качественные реакции на составные части нук- леопротеинов. Биуретовая реакция на полипептиды. К 5 каплям гидроли- зата приливают 10 капель 10% раствора едкого натра до отчетливой щелочной реакции (по лакмусу, опущенному в пробирку), затем 2 ка- пли 1% раствора сульфата меди; появляется розовая или розово- фиолетовая окраска. Серебряная проба на пуриновые основания. К 10 каплям гидро- лизата добавляют по каплям крепкий раствор аммиака — приблизи- тельно 10 капель до щелочной реакции (по лакмусу, опущенному в пробирку), затем добавляют 10 капель 2% аммиачного раствора нит- рата серебра. При стоянии через 3—5 мин образуется светло-ко- ричневый осадок серебряных солей пуриновых оснований (содержи- мое пробирки перемешивать при стоянии не надо). Качественная реакция на пентозу (Молиша). К 10 каплям гидролизата дрожжей добавляют 3 капли 1 % спир- тового раствора тимола, перемешивают и по стенке пробирки осто- рожно приливают 20—30 капель концентрированной серной кислоты. При встряхивании на дне пробирки образуется продукт конденсации фурфурола с тимолом красного цвета. При взаимодействии концентрированной серной кислоты с гек- созами или пентозами происходит дегидратация их: из пентоз образу- ется фурфурол, а изгексоз оксиметилфурфурол, которые дают с тимолом продукт конденсации →красного цвета:
Качествен- ная реакция на углевод. К 5 кап- лям гидролизата дрожжей приливают 3 капли 0,2% спиртового рас- твора α-нафтола и 20 капель концентрированной серной кислоты; по- является розово-фиолетовое окрашивание. Реакция на дезоксирибозу и рибозу. Дифениламин с дезоксири- бозой дает синее окрашивание, а с раствором рибозы — зеленое. К 5 каплям гидролизата дрожжей добавляют 20капель 1% раствора дифе- ниламина и кипятят в водяной бане в течение 15 мин; при этом обра- зуется сине-зеленое окрашивание. Молибденовая проба на фосфорную кислоту. К 10 каплям гидролизата приливают 20 капель молибденового реактива и кипятят. При этом жидкость окрашивается в лимонно-желтый цвет (не осадок). Пробирку сразу охлаждают в струе холодной воды. На дне пробирки появляется кристаллический лимонно-желтый осадок фосфорномо- либденовокислого аммония. Молибденовая проба на фосфорную кислоту:
|
||||
|
Последнее изменение этой страницы: 2016-12-16; просмотров: 566; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.142.251.204 (0.014 с.) |




 36
36





