Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Окисление и восстановление органических веществСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
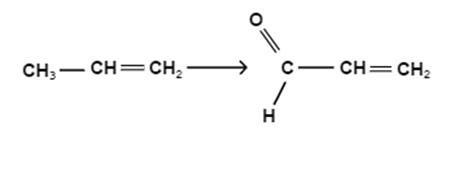
Повышенная склонность органических соединений к окислению обусловлена наличием в молекуле веществ: · кратных связей (именно поэтому так легко окисляются алкены, алканы, алкадиены); · определенных функциональных групп – сульфидной -SH, гидроксильной –OH (фенольной и спиртовой), аминной - NH · активированных алкильных групп, расположенных по соседству с кратными связям, например пропен может быть окислен до непредельного альдегида акролеина (кислородом воздуха в присутствии водяных паров на висмут- молибденовых катализаторах):
· атомов водорода при атоме углерода, содержащем функциональную группу. Сравним первичные, вторичные и третичные спирты по реакционной способности к окислению:
Первичные и вторичные спирты, имеющие атомы водорода при атоме углерода, несущем функциональную группу; окисляются легко: первые – до альдегидов, вторые до кетонов. При этом структура углеродного скелета исходного спирта сохраняется. Третичные спирты, в молекулах которых нет атома водорода при атоме углерода, содержащем групп ОН–, в обычных условиях не окисляются. В жестких условиях (при действии сильных окислителей и при высоких температурах) они могут быть окислены до смеси низкомолекулярных карбоновых кислот, т.е. происходит деструкция углеродного скелета. Существуют два подхода к определению степеней окисления элементов в органических веществах. 1. Вычисляют среднюю степень окисления атома углерода в молекуле органического соединения, например пропана. С3-8/3Н8+1 Такой подход оправдан, если в ходе реакции в органическом веществе разрушаются все химические связи (горение, полное разложение). Отметим, что формально дробные степени окисления, вычисленные таким образом, могут быть и в случае неорганических веществ. Например, в соединении КО2 (надпероксида калия) степень окисления кислорода равна – 1/2. 2. Определяют степень окисления каждого атома углерода, например в бутане. Н3+1С-3–С-2Н2+1– С-2Н2+1–С-3Н3+1 В этом случае степень окисления любого атома углерода в органическом соединении равна алгебраической сумме чисел всех связей с атомами более электроотрицательных элементов, учитываемых со знаком «+», и числа связей с атомами водорода (или другого более электроположительного элемента), учитываемых со знаком «-». При этом связи с атомами углерода не учитывают. В качестве простейшего примера определим степень окисления углерода в молекуле метанола. С-2Н3+1–ОН Атом углерода связан с тремя атомами водорода (эти связи учитываются со знаком «-»), одной связью – с атомом кислорода (ее учитывают со знаком «+»). Получаем: -3 + 1 = -2 Таким образом, степень окисления углерода в метаноле равна -2. Вычисленная степень окисления углерода хотя и условное значение, но оно указывает на характер смещения электронной плотности в молекуле, а ее изменение в результате реакции свидетельствует об имеющем место окислительно-восстановительном процессе. Рассмотрим цепочку превращений веществ:
При каталитическом дегидрировании этана получается этилен; продукт гидратации этилена – этанол; его окисление приведет к этаналю, а затем – к уксусной кислоте; при ее сгорании образуется углекислый газ и вода. Определим степени окисления каждого атома углерода в молекулах перечисленных веществ.
Можно заметить, что в ходе каждого из этих превращений постоянно меняется степень окисления одного из атомов углерода. В направлении от этана к оксиду углерода (IV) происходит увеличение степени окисления атома углерода. Несмотря на то, что в ходе любых окислительно-восстановительных реакций происходит как окисление, так и восстановление, их классифицируют в зависимости оттого, что происходит непосредственно с органическим соединением (если оно окисляется, говорят о процессе окисления, если восстанавливается – о процессе восстановления). Так, в реакции этанола с перманганатом калия этанол будет окисляться, а перманганат калия – восстанавливается. Реакцию называют окислением этанола
ЛАБОРАТОРНАЯ РАБОТА № 4. ИЗУЧЕНИЕ КИСЛОТНО-ОСНОВНЫХ СВОЙСТВ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ Цель: изучить и сравнить кислотно-основные свойства некоторых представителей спиртов и аминов.
|
||||
|
Последнее изменение этой страницы: 2016-12-16; просмотров: 918; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.137.177.116 (0.007 с.) |

 ;
;