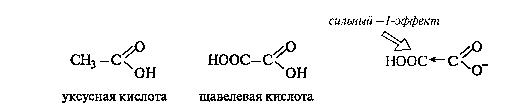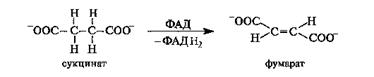Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Реакционная способность и специфические реакции дикарбоновых кислотСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Дикарбоновые кислоты образуют два ряда функциональных производных - по одной и по двум карбоксильным группам. Кислотные свойства. С накоплением кислотных групп увеличиваются кислотные свойства соединений. Кислотность дикарбоновых кислот больше, чем монокарбоновых. Так, щавелевая кислота (pKa 1,23) значительно сильнее уксусной (pKa4,76), что связано с -/- эффектом группы СООН, и благодаря этому более полной делокализации отрицательного заряда в сопряженном основании.
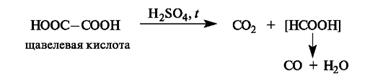
Влияние заместителя наиболее отчетливо проявляется при его близком расположении к кислотному центру. Декарбоксилирование. При нагревании с серной кислотой щавелевая кислота декарбоксилируется, а образовавшаяся муравьиная кислота разлагается далее.
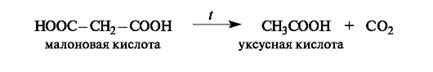
Малоновая кислота легко декарбоксилируется при нагревании выше 100 оС.
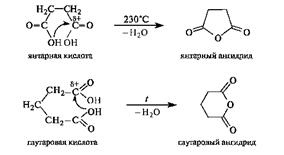
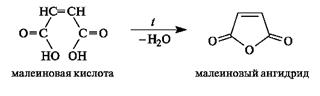
Образование циклических ангидридов. В дикарбоновых кислотах, содержащих четыре или пять атомов углерода в цепи и способных вследствие этого находиться в клешневидной конформации, происходит сближение в пространстве функциональных групп. В результате внутримолекулярной атаки одной карбоксильной группой (нуклеофилом) электрофильного центра другой карбоксильной группы происходит образование (при нагревании) устойчивого пятиили соответственно шестичленного циклического ангидрида, как показано на примерах янтарной и глутаровой кислот. Другими словами, ангидриды дикарбоновых кислот являются продуктами внутримолекулярной циклизации.
Малеиновая и фумаровая кислоты проявляют сходные химические свойства: вступают в реакции, свойственные соединениям с двойной связью (обесцвечивание бромной воды, водного раствора перманганата калия) и соединениям с карбоксильными группами (образуют два ряда производных - кислые и средние соли, эфиры и т. п.). Однако только одна из кислот, а именно малеиновая, в относительно мягких условиях претерпевает внутримолекулярную циклизацию с образованием циклического ангидрида. В фумаровой кислоте вследствие удаленности карбоксильных групп друг от друга в пространстве образование циклического ангидрида невозможно.
Окисление янтарной кислоты in vivo. Дегидрирование (окисление) янтарной кислоты в фумаровую, катализируемое в организме ферментом, осуществляется с участием кофермента ФАД. Реакция протекает стереоспецифично с образованием фумаровой кислоты (в ионной форме - фумарат).
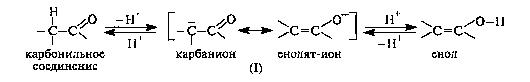
3.1.4. Таутомерия β -дикарбонильных соединений Определенная протонная подвижность атома водорода у α-атома углерода в карбонильных соединениях (слабого СН-кислотного центра) проявляется в их способности к реакциям конденсации. Если подвижность такого атома водорода возрастет настолько, что он сможет отщепиться в виде протона, то это приведет к образованию мезомерного иона (I), отрицательный заряд которого рассредоточен между атомами углерода и кислорода. Обратное присоединение протона к этому иону в соответствии с его граничными структурами может приводить либо к исходному карбонильному соединению, либо к енолу.
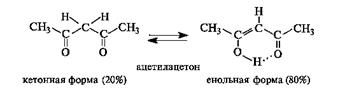
В соответствии с этим карбонильное соединение может существовать в равновесии с изомером - енольной формой. Такой вид изомерии называют таутомерией, а изомеры, находящиеся в состоянии подвижного Таутомерия - равновесная динамическая изомерия. Ее сущность заключается во взаимном превращении изомеров с переносом какой-либо подвижной группы и соответствующим перераспределением электронной плотности. В рассматриваемом случае между кетонной и енольной формами осуществляется перенос протона, поэтому такое равновесие называют прототропной таутомерией, в частности, кето-енольной таутомерией. В монокарбонильных соединениях (альдегидах, кетонах, сложных эфирах) равновесие практически полностью смещено в сторону кетонной формы. Например, содержание енольной формы в ацетоне составляет всего 0,0002%. При наличии второй электроноакцепторной группы у α-атома углерода (например, второй карбонильной группы) содержание енольной формы возрастает. Так, в 1,3-дикарбонильном соединении ацетилацетоне (пентандионе-2,4) енольная форма преобладает.
Енольная форма ацетилацетона дополнительно стабилизирована сопряженным со второй π-связью и внутримолекулярной водородной связью. Многие реакции, включающие образование и превращения карбонильных соединений in vivo, как будет показано в дальнейшем, протекают через промежуточные енольные формы или производные этих форм.
|
|||||
|
Последнее изменение этой страницы: 2016-12-16; просмотров: 1669; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.144.21.237 (0.007 с.) |