
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Опыт 5. Определение галогенов в органических веществахСодержание книги
Поиск на нашем сайте
Реактивы и оборудование: хлороформ, дистиллированная вода, соляная кислота, этиловый спирт, металлический натрий, 1%-ный раствор нитрата серебра, концентрированная азотная кислота, синяя лакмусовая бумага; медная проволока с петлей на конце, вставленная другим концом в корковую пробку, прямые газоотводные трубки, стаканы на 150 мл, пинцеты, скальпели, фильтровальная бумага. Реакция Бейльштейна на галогены. При прокаливании галогеносодержащего органического вещества с оксидом меди (II) происходит его окисление, причем галогены (кроме фтора) образуют с медью летучие галогениды, окрашивающие пламя в ярко-зеленый цвет. Петлю медной проволоки прокаливают в пламени горелки до прекращения окрашивания пламени и образования на поверхности черного налета оксида меди (II): 2Сu + О2 → 2СuО Остывшую петлю смачивают хлороформом или тетрахлоридом углерода, а затем снова вносят в пламя газовой горелки. Сначала пламя становится светящимся благодаря сгоранию углерода, а потом окрашивается в ярко-зеленый цвет: 2СНС13 + 5СuО → СuС12+ 4СuС1 + 2СО2 + Н2О Для очистки проволоку смачивают соляной кислотой и прокаливают. Метод Степанова (определение галогенов действием металлического натрия на спиртовой раствор органического вещества). Для определения галогена в органическом веществе его восстанавливают водородом в момент выделения, при этом галоген отщепляется в виде аниона, который можно открыть качественной реакцией с нитратом серебра. В пробирку наливают 2—3 мл этилового спирта и добавляют 1 каплю хлороформа или другого галогеносодержащего органического вещества (тетрахлорид углерода, йодоформ и др.). В полученную смесь вносят кусочек металлического натрия величиной с небольшую горошину. Начинается энергичная реакция, сопровождающаяся выделением водорода, причем часть водорода в момент выделения участвует в восстановлении хлороформа: 2С2Н5ОН + 2Na → 2C2H5ONa + 2[Н+] СНС13+ 6[Н+] → 3НС1 + СН4 НС1 + C2H5ONa → NaCl + С2Н5ОН Пробирку закрывают пробкой с прямой газоотводной трубкой и поджигают выделяющийся водород. После окончания выделения водорода и полного растворения натрия к реакционной смеси добавляют 2 мл дистиллированной воды. Избыток алкоголята натрия реагирует с водой с образованием гидроксида натрия: C2H5ONa + Н2О → С2Н5ОН + NaOH В воде также растворяется белый осадок хлорида натрия, плохо растворимый в этиловом спирте. Необходимо отметить, что в присутствии щелочи нельзя обнаружить хлорид-ион реакцией с нитратом серебра, так как при его добавлении будет образовываться бурый осадок гидроксида серебра. Поэтому полученный щелочной раствор подкисляют несколькими каплями концентрированной азотной кислоты (контроль по лакмусовой бумаге) и к кислому раствору добавляют несколько капель 1%-ного раствора нитрата серебра. Наблюдают выпадение белого творожистого осадка хлорида серебра: NaCl + AgNО3 → NaNO3 + AgCl Необходимо помнить, что при выполнении опыта нельзя брать избыток хлороформа, так как хлороформ, не прореагировавший с водородом, при разбавлении реакционной смеси водой дает стойкую белую эмульсию, которая в дальнейшем будет маскировать появление белого осадка при проведении качественной реакции с нитратом серебра.
ЛАБОРАТОРНАЯ РАБОТА №2. СООТНОШЕНИЕ ЛИНЕЙНОСТИ СВОБОДНОЙ ЭНЕРГИИ В ОРГАНИЧЕСКИХ ВЕЩЕСТВАХ.
Приборы и реактивы. Кислоты: бензойная, анилиния, п-толуиловая, м-толуиловая, п-хлорбензойная, м-хлорбензойная, п-оксибензойная, п-нитробензойная; хлористоводородные соли п-толуидина, м-толуидина, п-хлоранилиния, м-хлоранилиния, п-оксианилиния, п-нитроанилиния. Стандартный 0,01 н. раствор едкого натра, рН-метр, автоматическая бюретка на 10 мл класса А, магнитная мешалка Анилинийхлориды получают пропусканием сухого газообразного НС1 в охлаждаемый льдом безводный эфирный раствор соответствующего производного анилина; выпавшие соли перекристаллизовывают из этанола и отфильтровывают. Методика эксперимента. Возьмите навески (около 50 мг) каждой кислоты в чистые стаканы емкостью 100 мл. Растворите соли анилиния в К= [H3O+ ], или pK=pH.
Рисунок 2 – Общий вид кривой титрования
Обработка результатов. Вы стремились установить влияние заместителей на свободную энергию активации ∆F≠. При диссоциации это влияние должно проявляться в изменении log K, поскольку ΔF = RT ln K ≠ (В данном случае равновесная ∆F≠ представляет собой разность свободных энергий активации для прямой и обратной реакций, но это не сказывается на результатах.) Для того чтобы сравнить влияние заместителей, выбирают стандартный заместитель - атом водорода, электронные эффекты которого в реакции условно приняты равными нулю. Тогда бензойная кислота и анилинийхлорид являются стандартными кислотами в обеих сериях и имеют соответственно константы диссоциации K0 и К0`. Если рассмотреть замещенную бензойную кислоту (K) и соответствующую соль анилиния (К'), например п-хлорбензойную кислоту и n-хлоранилинийхлорид, то может оказаться, что влияние n-С1 на ионизацию каждой кислоты будет одинаковым по направлению, но не обязательно равным по величине, и тогда
где ρ0 и ρ являются константами реакций и выражаю т относительную чувствительность двух равновесий к электронным эффектам. Для всех других заместителей ρ0 и ρ будут одинаковы. Для удобства применения соотношения (1) можно ввести дальнейшие упрощения. Если реакцию ионизации бензойной кислоты при 25°С принять за стандартную, то ρ0 можно приравнять к единице и влияние заместителей на это равновесие окажется характеристикой только заместителя. Следовательно,
где σ - константа заместителя; K и σ относятся к определенному заместителю и определенному положению в кольце. Поэтому можно записать
Применимость этого соотношения ко многим реакциям бензольного кольца была показана Гамметом. 1. По уравнению (2) вычислите значения σ для всех рассмотренных заместителей, используя константы диссоциации бензойных кислот. 2. Для солей анилиния постройте зависимость σ от log (K'/Ko) Проведите через точки наилучшую прямую (по возможности по методу наименьших квадратов) и оцените ρ из наклона [уравнение (В)]. Интерпретация результатов. Введение электроноакцепторных групп увеличивает степень диссоциации кислот, так как протон уходит, оставив свои электроны:
Поэтому из уравнения (2) следует, что σ будет положительной (относительно водорода) для электроноакцепторных заместителей (logК > logK0) и отрицательной для электронодонорных (logК > logK0). Следовательно, можно определить величину электронного эффекта. Кроме того, если передача влияния осуществляется исключительно по индуктивному механизму (поляризация σ-связей), σ будет пример но одинаковой для мета- и пара-положений, обычно несколько больше для лета-положения, находящегося ближе к реакционному центру. Однако, если резонансные структуры дают вклад в перенос заряда, влияние будет больше (положительное или отрицательное) из пара-положения. Знак и величина ρ также являются информативными; положительное значение указывает на большую чувствительность рассматриваемой реакции к электронным эффектам по сравнению с реакцией ионизации бензойных кислот.
ЛАБОРАТОРНАЯ РАБОТА №3. ГЕОМЕТРИЧЕСКАЯ ИЗОМЕРИЯ И ПРОТОННЫЙ РЕЗОНАНС В ОРГАНИЧЕСКИХ МОЛЕКУЛАХ Необходимые реактивы. Ацетоуксусный эфир, амальгама натрия (1%), пятихлористый фосфор, бензол (безводный)
|
||||
|
Последнее изменение этой страницы: 2016-12-16; просмотров: 3509; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.147.6.122 (0.009 с.) |


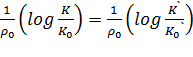 (1)
(1) (2),
(2), (3).
(3).



