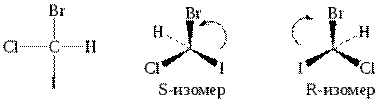Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Свойства структурных изомеровСодержание книги
Поиск на нашем сайте
Структурные изомеры существенно различаются между собой физическими, химическими и физиологическими свойствами. - Ткип у разветвленных алканов ниже, чем у неразветвленных. - Тпл выше у тех изомеров, которые имеют более симметричную структуру.
Таутомерия «таутос» - тот же самый, «мерос» - доля, часть (греч.). Таутомерия – явление динамического обратимого превращения изомеров, протекающее с разрывом и образованием связей и сопровождающееся перемещением атомов (чаще всего протона) и реже групп атомов. Изомерные формы – таутомеры. В отличие от структурных изомеров, таутомеры, как правило, не могут существовать отдельно друг от друга. Независимое их получение невозможно. Основным признаком таутомерных веществ является их двойственное реагирование – способность к образованию двух рядов производных как результат раздельного и самостоятельного реагирования двух находящихся в равновесии изомерных форм одного соединения. Виды таутомерии
Геометрическая изомерия - разновидность стереоизомерии, которая определяется различием пространственного расположения в молекулах пары заместителей относительно плоскости двойной связи или цикла. Обусловлена тем, что в молекулах этих веществ свободное вращение атомов вокруг σ-связей (циклоалканы) и относительно π-связей (алкены) оказывается невозможным.
Z,E-номенклатура (для три- и тетразамещенных алкенов). Конфигурацию изомера определяют по относительному расположению старших заместителей. По одну сторону плоскости – Z-изомер; по разные – Е-изомер. В основе определения старшинства находится атомный номер элемента. В случае одинаковых атомов старшинство группы определяет «вторая оболочка» атомов: -СН3< -СН2СН3< -СН(СН3)2< -СН2NН2< -CH2OH< -CH2F В случаях групп с различным типом связи старшинство увеличивается в рядах: -CH2OH < -COH < COR < COOH -CH2NH2< -CH=NH < -CN
Е-изомер Z-изомер Вследствие того, что расстояния между заместителями в молекулах изомеров различны, последние существенно различаются своими химическими и физическими свойствами. Они могут быть разделены и существовать индивидуально.
Переход одного изомера в другой – изомеризация протекает обычно при нагревании или облучении.
Конформационная изомерия - разновидность стереоизомерии, которая определяется различием пространственного расположения в молекулах заместителей, возникающее в результате свободного вращения вокруг σ-связей. Такие изомеры различаются между собой стабильностью. Более стабильные конформации, которые фиксируются физико-химическими методами, называются конформерами.
Изображение конформеров – проекции Ньюмена:
Чем больше сила взаимного отталкивания атомов водорода, тем выше энергия системы; поэтому заторможенной конформации будет соответствовать минимум потенциальной энергии молекулы. Принимая различные конформации, молекулы остаются химически однородными; конформации не являются типичными изомерами. Однако, в некоторых случаях (при тесной упаковке молекул), можно разделить различные формы. Конформации биоорганических молекул (ферменты, витамины, белки, нуклеиновые кислоты) играют определяющую роль в проявлении последними биологической активности. Коформации в ряду циклических углеводородов:
Конфигурационная изомерия Объёмные структуры циклических соединений содержат разные по природе положения заместителей:
Оптическая изомерия Некоторые органические соединения являются оптически активными. Они способны изменять плоскость поляризации света при прохождении его через образец вещества (1815 г. Ж. Био). Свет – электромагнитные волны, колебания которых перпендикулярны направлению их распространения. В естественном (солнечном) свете эти колебания происходят в различных плоскостях.
Оптически активные соединения поворачивают плоскость поляризации на определённый угол вправо (правовращающие) или влево (левовращающие). Изомеры, вращающие плоскость поляризации в разные стороны, но на один и тот же угол – антиподы (энантиомеры). Рацемическая смесь (рацемат) – смесь, состоящая из равных количеств лево- и правовращающих изомеров. Рацемат оптически не активен. Оптическая активность характерна для соединений содержащих
Изображение энантиомеров
Для того, чтобы связать строение с вращением, было предложено выбрать соединение-стандарт и сравнить с ним все другие соединения, содержащие хиральный центр. В качестве стандарта был выбран
R,S- номенклатура Для отнесения стереоизомера необходимо определить в нем старшинство заместителей (порядковый номер элемента – как в случае Z,E-изомерии). Взгляд наблюдателя направляется по оси С-младший заместитель (Н). После такой ориентации смотрят, как три заместителя располагаются в ряд в направлении от старшего к младшему. В случаеR-конфигурации этот порядок соответствует направлению движения по часовой стрелке, в случаеS-конфигурации – против часовой стрелки.
Если молекуле имеется несколько хиральных центров, то число изомеров возрастает и равняется 2n, где n - число хиральных центров.
В отличие от структурных изомеров энантиомеры идентичны один другому в большинстве своих свойств. Они отличаются только по своему взаимодействию с плоскополяризованным светом и взаимодействием с веществами, которые также являются хиральными. В организме реакции протекают с участием биокатализаторов - ферментов. Ферменты построены из хиральных молекул α-аминокислот. Поэтому они играют роль хиральных реагентов, чувствительных к хиральности взаимодействующих с ними субстратов (стереоспецифичность биохимических процессов). Это приводит к тому, что хиральные природные соединения представлены, как правило, лишь одной стереоизомерной формой (D-углеводы, L-аминокислоты). Стереоспецифичность лежит в основе проявления биологического действия одним из энантиомеров, в то время, как другой изомер может быть неактивным, а иногда оказывать иное или даже противоположное действие.
1.3 Химическая связь в органических соединениях
При образовании химической связи выделяется энергия, поэтому появление двух новых валентных возможностей приводит к выделению дополнительной энергии (1053,4 кДж/моль), которая превосходит энергию, затраченную на распаривание 2s электронов (401 кДж/моль). Различные по форме орбитали (s,p) при образовании связи смешиваются, давая новые равноценные гибридизованные орбитали (теория гибридизации, Л.Полинг, Д.Слэтер, 1928-1931 гг.). Понятие гибридизации относится только к молекулам, но не к атомам, и в гибридизацию вступают только орбитали, а не электроны на них. В отличие от негибридизованных s- и p- орбиталей гибридная орбиталь полярна (электронная плотность смещена) и способна образовывать более прочные связи.
|
||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-16; просмотров: 1320; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.144.28.90 (0.007 с.) |

 α-нафтиламин β-нафтиламин
вызывает рак
мочевого пузыря
α-нафтиламин β-нафтиламин
вызывает рак
мочевого пузыря