
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Основность органических соединений.Содержание книги
Поиск на нашем сайте
Органические соединения, в состав молекулы которых входят атомы азота, кислорода, серы, могут выступать в роли оснований, присоединяя протон водорода за счет неподеленной пары электронов на внешнем энергетическом уровне. Гетероатом в молекуле органического вещества, присоединяющий протон, называется центром основности. Основания по Бренстеду делятся на n– основания и π – основания. n – Основания могут быть нейтральными или отрицательно заряженными частицами. К ним относятся:аммониевые (R3N,R=NH,RCN), оксониевые (RC(O)R1,R-O-R1), сульфониевые (R-S-R1,RC(S)R1) . π-основания (алкины, алкены, диены, арены) в них центром основности являются электроны π-связи. Это очень слабые основания, так как протонируемые электронные пары несвободны. Сила основания определяется стабильностью образующегося катиона (сопряженной кислоты). Чем стабильнее катион, тем сильнее основание. Для количественной характеристики основности обычно используют величину pKBH+ - показатель константы основности сопряженной кислоты. Чем большеpKBH+, тем сильнее основание. Факторы, влияющие на основность 1. Природа гетероатома в основном центре Н3С -NH2> Н3С -OHН3С -OH> Н3С –SH Сила оснований зависит от электроотрицательности гетероатома в основном центре. Чем больше ЭО атома, тем слабее основные свойства, поэтому спирты и простые эфиры являются более слабыми основаниями по сравнению с аминами. 2. Строение радикала, связанного с основным центром.
Алифатические амины проявляют более выраженные основные свойства, чем ароматические, так как электронная плотность от углеводородного радикала смещается к NH2, а чем больше электронной плотности на основном центре, тем лучше присоединяется Н+. в ароматических аминахNH2входит в общее сопряжение с бензольным кольцом и отдает электронную плотность на кольцо, поэтому Н+присоединяется труднее, основные свойства слабее. 3. Влияние заместителей. Электронодонорые заместители усиливают основные свойства, а электроноакцепторные – уменьшают, например:
РКВН+5,1 4,6 1,0
Влияние растворителя В водной среде важную роль играет уменьшение пространственных препятствий для гидратации, поэтому вторичные амины лучше гидратируются, чем третичные, которые пространственно труднодоступны. H
В газовой среде основность возрастает с увеличением углеводородных радикалов, так как усиливается их стабилизирующее действие за счет +I- эффекта на катион сопряженной кислоты, поэтому третичные амины проявляют более сильные основные свойства по сравнению с другими аминами. H
4. Теория Льюиса. Дж. Льюисом (1923) была предложена более общая теория кислот и оснований, опирающаяся на строение внешних электронных оболочек атомов. По теории Льюиса кислотные и основные свойства соединений определяются их способностью принимать или отдавать пару электронов с образованием связи. Кислотами Льюиса могут быть атом, молекула или катион, обладающие вакантной орбиталью и способные принимать пару электронов с образованием ковалентной связи.Примерами аогут служить галогениды элементов второй и третьей групп ПСЭ (BF3,AlCl3,FeCl3,ZnCl2, катионы металлов, Н+. кислоты Льюиса в гетеролитических реакциях участвуют как электрофильные реагенты. Основаниями Льюиса могут быть атом, молекула или анион, имеющие пару валентных электронов, которые они должны предоставить партнеру для образования ковалентной связи. Основания Льюиса представляют собой нуклеофильные реагенты. К ним относятся амины, спирты, простые эфиры, тиолы, тиоэфиры, соединения, содержащие π-связи или систему сопряженных π-связей. Важным следствием теории Льюиса является то, что любое органическое соединение можно представить как кислотно-основной комплекс. Например, этилиодид можно рассматривать как комплекс, состоящий из этил-катиона С2Н5+(кислота Льюиса) и иодид иона –I (основание Льюиса). Отсюда большинство реакций с этилиодидом можно классифицировать как обмен иодид-иона на другие основания Льюиса (ОН-, СN-,NH2-,H3C-O-) или как обмен этил-катиона на другие кислоты Льюиса (К+, Н+и др.).
2.2 Радикальные и электрофильные реакции углеводородов и их производные
Реакции радикального замещения (SR) Реакции SR наиболее характерны для соединений алифатического и ациклического рядов. Как правило, они протекают по цепному механизму, основными стадиями которого являются: инициирование, развитие (рост цепи) и обрыв цепи. На стадии инициирования образуются свободные радикалы, дающие начало цепному процессу. Свободные радикалы могут возникать за счет термического или фотохимического инициирования, а также в результате ОВ реакций. Стадия развития цепи протекает при низкой энергии активации. Обрыв цепи возникает в случае рекомбинации свободных радикалов.
|
||||
|
Последнее изменение этой страницы: 2016-12-16; просмотров: 2847; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.144.116.34 (0.009 с.) |

 анилин Н3С → СН2→NH2 этиламин
анилин Н3С → СН2→NH2 этиламин 4-хлоранилин
4-хлоранилин  анилин
анилин 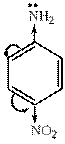 4-нитроанилин
4-нитроанилин уменьшение основности
уменьшение основности 3C - NH – CH3 > H3C – NH2– CH3> H3C - N – CH3
3C - NH – CH3 > H3C – NH2– CH3> H3C - N – CH3 основность уменьшается
основность уменьшается 3C - N – CH3 > H3C – NH – CH3 > H3C – NH2–CH3
3C - N – CH3 > H3C – NH – CH3 > H3C – NH2–CH3 основность уменьшается
основность уменьшается


