
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Соединения углерода с отрицательной степенью окисления. (см. выше п.1)Содержание книги
Поиск на нашем сайте
Углерод и Кремний План. 1. Углерод как химический элемент. 2. Простые вещества. Аллотропия углерода. Адсорбция. 3. Соединения углерода с отрицательной степенью окисления. 4. Оксиды углерода. 5. Угольная кислота и ее соли. 6. Жесткость воды. 7. Кругооборот углерода в природе. 8. Кремний как химический элемент. 9. Простые вещества. Аллотропия кремния. 10. Соединения кремния с отрицательной степенью окисления. 11. Оксид кремния. 12. Кремниевая кислота и ее соли. 13. Силикаты в природе. Силикатная промышленность.
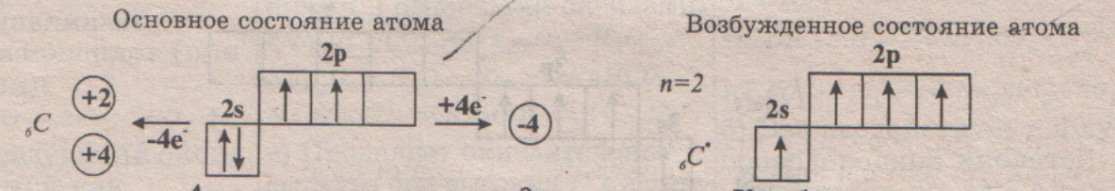
Положение в ПС: №6, 2 период, 4 группа, главная подгруппа, Аr = 12. Состав атома: 6p, 6e-, 6n. Заряд ядра +6, два электронных слоя: 2e-,4е-. Электронная формула 1s2 2s2 2p2. На внешнем слое 4 электрона, слой не завершен, заполнен на половину, но радиус атома маленький => не очень высокая ЭО, но углерод - неметалл. Два e- неспаренные => возможна валентность (II), она проявляется в оксиде углерода (П) - СО. Но наличие свободной р-орбитали делает возможным переход S-электрона на нее и появление четырех неспаренных e-, и тогда возможна валентность (IV). Эта валентность более характерна для углерода и проявляется практически во всех его соединениях. Возможна отрицательная с.о. (-4), она проявляется в соединениях с металлами – карбидах и в соединениях с водородом. Но это формально. Потому что состав многих карбидов и тем более водородных соединений не отвечает обычным степеням окисления. Карбиды в школьной программе не изучаются, а с водородными соединениями мы познакомимся подробней в курсе органической химии. Вам пока надо знать только простейшее ЛВС углерода – метан СН4. Положительные с.о. (+2, +4) углерод проявляет в соединениях с кислородом, азотом, серой и галогенами (кроме иода). Причем, +2 проявляется крайне редко (см. валентность). Распространение в природе: углерод составляет 0,1% по массе на Земле (он не входит даже в первую десятку!). Встречается углерод и в свободном состоянии (в виде простого вещества), и в виде множества неорганических и органических соединений. По численности и разнообразию своих соединений углерод занимает в природе первое место. Это объясняется способностью его атомов образовывать между собой длинные цепи, прочностью и лабильностью этих связей, и способностью углерода легко терять и присоединять электроны. Соединения углерода с водородом и их производные мы будем изучать позже, в органической химии, а сейчас познакомимся с простыми веществами образованными этим элементом, оксидами, кислотой и солями, образованными элементом углеродом.
Карбин: кристаллическая решетка построена из линейных цепочек. Полупроводник. Черный порошок, плотность 1,9 г/см3. Встречается в природе очень редко. При нагревании до 2800оС (без доступа воздуха) карбин превращается в графит. Фуллере́н (бакибо́л) — молекулярное соединение, принадлежащее классу аллотропных форм углерода и представляющее собой выпуклые замкнутые многогранники, составленные из чётного числа трёх координированных атомов углерода. После получения в лабораторных условиях такие молекулы углерода были найдены в некоторых образцах шунгитов Северной Карелии, в фульгуритах США и Индии, в метеоритах и донных отложениях. Но только в очень небольших количествах.
Химические свойства всех аллотропических модификаций одинаковы, но у них разная активность. Легче всего в реакции вступает аморфный углерод. Углерод - неметалл, он может быть и окислителем, и восстановителем. Как окислитель углерод взаимодействует с металлами и водородом: С +Н2 → СН4 (метан), при повышенной температуре и давлении, в присутствии катализатора. С +Са → СаС2 (карбид кальция), при повышенной температуре Как восстановитель углерод при нагревании взаимодействует с кислородом и другими активными неметаллами, с оксидами. Восстановительные свойства для него более характерны, чем окислительные. Например: 1) С + О2 → СО или С + О2 → СО2 2) С + CuО → СО + Cu или С + CuО → СО2 + Cu 3) С + Fe2O3→ СО2 + Fe или С + Fe2O3→ СО + Fe 4) С + H2O→ СО + H2 Последнюю реакцию в промышленности обычно прерывают на первой стадии, потому что образовавшаяся смесь газов СО и H2 широко используется для синтеза органических соединений. Получение углерода: В природе распространен каменный уголь (антрацит и др. виды), графит, остальные (алмаз,фуллере́н) - встречаются крайне редко. Поэтому углерод получают в промышленности при термическом разложении органических веществ без доступа воздуха (в виде сажи, древесного угля, кокса). Применение (см. выше п.2). Оксиды углерода. СО – оксид углерода (II), угарный газ. С=О – структурная формула. Газ без цвета и запаха, чуть легче воздуха, температура кипения -192 0С, очень ядовит. Плохо растворяется в воде и не взаимодействует с ней. Несолеобразующий оксид. Обладает восстановительными свойствами.
СО + О2 →СО2 2) восстанавливает металлы из их оксидов: СО + CuО → СО2 + Cu СО +Fe2O3 → СО2 + Fe Получение: при температуре 500-8000С и недостатке кислорода. С + СО2 → СО (в газогенераторах и доменных печах, подземная газификация угля). Применение: 1) как топливо;
3) как сырье для органического синтеза. СО2 - оксид углерода (IV), углекислый газ. О=С=О – структурная формула. Газ без цвета и запаха, при 200С и 60 атм давления он превращается в жидкость. Если эту жидкость вылить быстро из сосуда, то она превратится в твердую снегообразную массу - «сухой лед». Твердый оксид углерода (IV) возгоняется (т.е. не плавясь переходит сразу в газообразное состояние) при -78,5 0С. Углекислый газ содержится в воздухе (около 0,04%), растворим в воде (при 180С 1:1), при понижении температуры и повышении давления растворимость увеличивается. Раствор углекислого газа в воде имеет кисловатый вкус, изменяет окраску индикатора, потому что происходит химическое взаимодействие: СО2↑ + H2O ↔ H2СО3, причем равновесие этой реакции сильно сдвинуто в сторону образования углекислого газа. Образующаяся кислота называется угольной. Т.е. углекислый газ – это кислотный оксид. Он взаимодействует с основными оксидами и основаниями: СО2↑+Na2O → Na2CO3 СО2↑+2Са(OH)2 → СаCO3↓ + H2O – эту реакцию используют как качественную, для определения углекислого газа. Здесь Са(OH)2 – насыщенный раствор гидроксида кальция, «известковая вода», при пропускании через нее углекислого газа появляется белый осадок. СО2↑+2NaOH → Na2CO3 + H2O или в избытке углекислого газа СО2↑+NaOH + H2O → NaHCO3 При высоких температурах СО2 проявляет окислительные свойства, например, магний горит в углекислом газе: Mg + CO2↑→ MgO + C Получение: 1) в промышленности при обжиге известняка СаСО3→ СаО + СО2↑ 2) в лаборатории – действуя соляной кислотой на мрамор или мел СаСО3 + HCl → СаCl2 + H2O + СО2↑ Применение. 1) производство карбонатов (сода, поташ и т.д.); 2) очистка сахара и других пищевых продуктов; 3) газирование воды; 4) тушение пожаров; 5) в переносных холодильниках (сухой лед). Угольная кислота и ее соли. H2СО3 - может существовать только в разбавленных растворах, т.е. равновесие смещено к оксиду и воде. СО2↑ + H2O ↔ H2СО3+ Q При нагревании равновесие еще больше смещается в сторону углекислого газа и, в конце концов, вся кислота разлагается, углекислый газ улетучивается и остается только вода. Поэтому принято говорить: угольная кислота нестойкая. Равновесие можно сместить в сторону образования кислоты создав повышенное давление углекислого газа (при повышении давления растворимость газов увеличивается!). Кроме того, угольная кислота очень слабая, т.е. она в незначительной степени диссоциирует по первой ступени (К=10-7), а по второй еще меньше (К=10-11). H2СО3↔ Н+ + НСО3- (гидрокарбонат-ион) НСО3- ↔2Н+ + СО32- (карбонат-ион) Угольная кислота образует два ряда солей: карбонаты (СаСО3 , Na2CO3) и гидрокарбонаты (NaHCO3, Са(НСО3)2). Между ними существует равновесие: СаСО3 + СО2↑ + H2O ↔ Са(НСО3)2+ Q Na2CO3 + СО2↑ + H2O ↔ 2NaHCO3 + Q
Для определения присутствия карбонатов и гидрокарбонатов в растворе или в сухой смеси чаще всего пользуются какой-нибудь сильной кислотой. При этом наблюдается «вспенивание» - выделение пузырьков углекислого газа. СаСО3 + HCl → СаCl2 + H2O + СО2↑ NaHCO3 + HNO3→ NaNO3 + H2O + СО2↑ Потому что 2Н+ + СО32- → H2СО3 → СО2↑ + H2O Все карбонаты, кроме солей щелочных металлов, разлагаются при нагревании: СаСО3→ СаО + СО2↑ Применение. 1) NaHCO3 – питьевая сода, в пищевой промышленности – разрыхлитель теста, пищевая добавка, моющее средство; в медицине – средство против изжоги; 2) Na2CO3 – кальцинированная сода, для производства СМС, мыла, стекла, бумаги в текстильной нефтехимической промышленности и т.д.; кристаллогидрат Na2CO3∙ 10H2O называют просто - содой. 3) К2CO3 – поташ, изготовление жидкого мыла, стекла, в фотографии; 4) СаСО3 – известняк (строительный материал (ракушка, инкерманский камень, бут) и сырье для получения цемента, негашеной и гашеной извести), мел (строительный материал), мрамор (строительный и поделочный материал); 5) MgСО3 – магнезит (для получения цемента), FeСО3 – шпатовый железняк (железная руда), ZnСО3- галмей (цинковая руда). Жесткость воды. Жесткость воды обусловлена присутствием в ней растворимых солей Са и Mg. Иногда ее называют общей жесткостью. Общая жесткость состоит из карбонатной (временной) жесткости и некарбонатной (постоянной) жесткости. Карбонатная жесткость обусловлена присутствием в воде гидрокарбонатов кальция и магния, некарбонатная – всех остальных растворимых солей кальция и магния. Смягчение воды (удаление из нее карбонатов и гидрокарбонатов кальция и магния) можно достигнуть простым кипячением: Са(НСО3)2 → СаСО3↓ + СО2↑ + H2O или добавлением гашеной извести: Са(НСО3)2 + Ca(OH)2 → СаСО3↓ + H2O. Существуют и более эффективные способы смягчения воды. Добавление соды, фосфатов переводит в осадок не только гидрокарбонаты, но и другие соли кальция и магния, полностью очищая от них воду. Например: Са(НСО3)2 + Na2CO3→ СаСО3↓ + NaHCO3
Са(НСО3)2 + Na3PO4→ Са3(PO4)2↓ + NaHCO3 CaCl2 +Na3PO4→ Са3(PO4)2↓ + 2NaCl Удалять из воды ионы кальция и магния необходимо, чтобы не образовывалось накипи в трубах и котлах водонагревательных приборов и тепловых двигателей (из-за этого увеличивается расход топлива и возникает угроза аварии), чтобы повысить моющее действие стиральных порошков и мыла (часть моющего средства идет в жесткой воде на образование малорастворимых соединений Са и Mg). Экологические проблемы, связанные с повышением содержания углекислого газа в атмосфере. Парниковый эффект. Повышение среднегодовой температуры. Таяние ледников. Повышение уровня мирового океана Применение. 1. Монокристаллы кремния с соответствующими добавками служат для изготовления фотоэлементов (солнечные батареи и прочее…), диодов и триодов (выпрямители и усилители в электрических устройствах). 2. В металлургии кремний используют для «раскисления» сталей и придания им повышенной коррозионной стойкости. 9. Соединения кремния с отрицательной степенью окисления. Силициды (соединения кремния с активными металлами) используются для получения жаростойких и кислотоупорных сплавов, высокотемпературных полупроводниковых материалов. 10. Гораздо чаще и в природе, и на производстве мы имеем дело с кислородными соединениями кремния в которых он имеет устойчивую положительную степень окисления.
Особой разновидностью кварца является кремень, минеральное образование, состоящее из кристаллического и аморфного кремнезёма (SiO2) в осадочных горных породах. Часто окрашен окислами железа и марганца в разные цвета. Это непрозрачная, очень твердая горная порода, дающая острые сколы. Древние люди использовали ее для получения огня и изготовления орудий труда.
Оксид кремния химически инертен, в воде не растворяется. Но при сплавлении он взаимодействует со щелочами, т.е. оксид кремния является кислотным оксидом. SiО2+2NaOH → Na2SiO3 + H2O При высоких температурах окисляет активные металлы, т.е. может проявлять окислительные свойства, но слабо: Mg + SiО2 →MgО + Si Особым химическим свойством оксида кремния является его способность растворяться в плавиковой кислоте. Этот процесс используют для травления стекла. SiО2+ HF→SiF4 +H2O Применение: 1). песок - в строительстве; 2). песок - в производстве стекла; 3). песок - в производстве керамики (фарфор, фаянс, кирпич); 4). песок - в производстве цемента; 5). монокристаллы - в радиотехнике и радиоэлектроника (выпрямители и усилители, звукозаписывающая и звуковоспроизводящая аппаратура), приборостроении (ультразвуковые приборы: коллоидные мельницы, стиральные машины, УЗИ и т.д.); 6). кварцевое стекло - оптические и химические приборы 7). в аморфном виде – как осушители и адсорбенты. Силикаты в природе.
Состав наиболее распространенных природных силикатов: белая глина (каолин) – Al2O3∙2SiО2∙2H2O
нефелин – Na2O∙ Al2O3∙2SiО2 слюда - К2О∙ 3Al2O3∙6SiО2∙2H2O асбест - СаО∙3MgО∙4 SiО2 Роль кремния в организме и применение его соединений в медицине. Содержание кремния в организме – 10-3 %. Один из важнейших микроэлементов. Кремний влияет на образование и функционирование эпителиальных и соединительных тканей, придавая им прочность и пластичность, он препятствует проникновение липидов в плазму крови и отложению их на стенках сосудов; с нарушением обмена кремния связывают возникновение гипертонии, атеросклероза, ревматизма, язвы, малокровия и т. д. Оксид кремния (силикагель) используется как хороший адсорбент. Тальк используют как присыпку, он входит в состав многих косметических препаратов. 13. Применение. Силикатная промышленность 1) глина – при изготовлении фарфора, фаянса, керамики; как строительный вяжущий материал; 2) гранит – как строительный материал; 3) слюда и асбест – электро- и теплоизоляционные материалы; 4) алюмосиликаты – для смягчения и очистки воды;
Упражнения №1. Записать схему строения, электронную и графическую формулу углерода (Карбона). Верно ли утверждение, что углерод – типичный неметалл? Почему? Какова возможная валентность углерода в его соединениях? Почему? Приведите примеры таких соединений. Какова минимальная и максимальная степень окисления углерода? Почему? Приведите примеры таких соединений. №2. Что такое аллотропия? Какие наиболее важные аллотропические модификации Карбона вам известны? Сделайте вывод: от чего зависят свойства веществ? №3. Что такое активированный уголь? Чем он отличается от обычного древесного угля и для чего его применяют? №4. Напишите уравнения взаимодействия углекислого газа со следующими веществами: оксид лития, гидроксид калия, кальций. Какая из этих реакций относится к ОВР? Определите в ней окислитель и восстановитель. №5. Назовите эти вещества. С помощью каких реакций можно осуществить следующие превращения? Запишите уравнения этих реакций. А) С → CO → CO2 → Na2CO3 → Mg(CO3)2 Б) C → CH4 → CO2 → K2CO3 → CO2 B) C3H8 → CO2 → H2CO3 → CaCO3 → Ca(HCO3)2 №6. Напишите уравнения возможных реакций кремниевой кислоты со следующими веществами: оксид алюминия, гидроксид натрия, магний. Поясните, почему не все реакции возможны. №7. Назовите эти вещества. С помощью каких реакций можно осуществить следующие превращения? Запишите уравнения этих реакций. А) Si → SiO2 → K2SiO3 → H2SiO3 → CaSiO3 Б) H2SiO3 → SiO2 → Si → Mg2Si → SiO2 №8. Как определить в растворах соли угольной кислоты? Запишите соответствующие уравнения. Для чего в основном используют соли угольной кислоты? №9 Что такое стекло? От чего зависят свойства стекла? Какими уникальными свойствами обладает кварцевое стекло? №10 Дайте сравнительную характеристику состава и свойств оксидов, образованных Карбоном. Сделайте вывод: в чем причина сходства и различия между этими веществами? №11. Запишите уравнения реакций между сажей и следующими веществами: а) кислородом; б) железом; в) фосфором. Что измениться в уравнениях, если вместо сажи взять графит? Обозначьте степени окисления элементов в уравнениях, определите окислитель и восстановитель. Сделайте вывод о химических свойствах углерода. №12. Как определить в растворах соли угольной кислоты? Запишите соответствующие уравнения. Для чего в основном используют соли угольной кислоты? Углерод и Кремний План. 1. Углерод как химический элемент. 2. Простые вещества. Аллотропия углерода. Адсорбция. 3. Соединения углерода с отрицательной степенью окисления. 4. Оксиды углерода. 5. Угольная кислота и ее соли. 6. Жесткость воды. 7. Кругооборот углерода в природе. 8. Кремний как химический элемент. 9. Простые вещества. Аллотропия кремния. 10. Соединения кремния с отрицательной степенью окисления. 11. Оксид кремния. 12. Кремниевая кислота и ее соли. 13. Силикаты в природе. Силикатная промышленность.
Положение в ПС: №6, 2 период, 4 группа, главная подгруппа, Аr = 12. Состав атома: 6p, 6e-, 6n. Заряд ядра +6, два электронных слоя: 2e-,4е-. Электронная формула 1s2 2s2 2p2. На внешнем слое 4 электрона, слой не завершен, заполнен на половину, но радиус атома маленький => не очень высокая ЭО, но углерод - неметалл. Два e- неспаренные => возможна валентность (II), она проявляется в оксиде углерода (П) - СО. Но наличие свободной р-орбитали делает возможным переход S-электрона на нее и появление четырех неспаренных e-, и тогда возможна валентность (IV). Эта валентность более характерна для углерода и проявляется практически во всех его соединениях. Возможна отрицательная с.о. (-4), она проявляется в соединениях с металлами – карбидах и в соединениях с водородом. Но это формально. Потому что состав многих карбидов и тем более водородных соединений не отвечает обычным степеням окисления. Карбиды в школьной программе не изучаются, а с водородными соединениями мы познакомимся подробней в курсе органической химии. Вам пока надо знать только простейшее ЛВС углерода – метан СН4. Положительные с.о. (+2, +4) углерод проявляет в соединениях с кислородом, азотом, серой и галогенами (кроме иода). Причем, +2 проявляется крайне редко (см. валентность). Распространение в природе: углерод составляет 0,1% по массе на Земле (он не входит даже в первую десятку!). Встречается углерод и в свободном состоянии (в виде простого вещества), и в виде множества неорганических и органических соединений. По численности и разнообразию своих соединений углерод занимает в природе первое место. Это объясняется способностью его атомов образовывать между собой длинные цепи, прочностью и лабильностью этих связей, и способностью углерода легко терять и присоединять электроны. Соединения углерода с водородом и их производные мы будем изучать позже, в органической химии, а сейчас познакомимся с простыми веществами образованными этим элементом, оксидами, кислотой и солями, образованными элементом углеродом.
Карбин: кристаллическая решетка построена из линейных цепочек. Полупроводник. Черный порошок, плотность 1,9 г/см3. Встречается в природе очень редко. При нагревании до 2800оС (без доступа воздуха) карбин превращается в графит. Фуллере́н (бакибо́л) — молекулярное соединение, принадлежащее классу аллотропных форм углерода и представляющее собой выпуклые замкнутые многогранники, составленные из чётного числа трёх координированных атомов углерода. После получения в лабораторных условиях такие молекулы углерода были найдены в некоторых образцах шунгитов Северной Карелии, в фульгуритах США и Индии, в метеоритах и донных отложениях. Но только в очень небольших количествах.
Химические свойства всех аллотропических модификаций одинаковы, но у них разная активность. Легче всего в реакции вступает аморфный углерод. Углерод - неметалл, он может быть и окислителем, и восстановителем. Как окислитель углерод взаимодействует с металлами и водородом: С +Н2 → СН4 (метан), при повышенной температуре и давлении, в присутствии катализатора. С +Са → СаС2 (карбид кальция), при повышенной температуре Как восстановитель углерод при нагревании взаимодействует с кислородом и другими активными неметаллами, с оксидами. Восстановительные свойства для него более характерны, чем окислительные. Например: 1) С + О2 → СО или С + О2 → СО2 2) С + CuО → СО + Cu или С + CuО → СО2 + Cu 3) С + Fe2O3→ СО2 + Fe или С + Fe2O3→ СО + Fe 4) С + H2O→ СО + H2 Последнюю реакцию в промышленности обычно прерывают на первой стадии, потому что образовавшаяся смесь газов СО и H2 широко используется для синтеза органических соединений. Получение углерода: В природе распространен каменный уголь (антрацит и др. виды), графит, остальные (алмаз,фуллере́н) - встречаются крайне редко. Поэтому углерод получают в промышленности при термическом разложении органических веществ без доступа воздуха (в виде сажи, древесного угля, кокса). Применение (см. выше п.2). Соединения углерода с отрицательной степенью окисления. (см. выше п.1) Оксиды углерода. СО – оксид углерода (II), угарный газ. С=О – структурная формула. Газ без цвета и запаха, чуть легче воздуха, температура кипения -192 0С, очень ядовит. Плохо растворяется в воде и не взаимодействует с ней. Несолеобразующий оксид. Обладает восстановительными свойствами.
СО + О2 →СО2 2) восстанавливает металлы из их оксидов: СО + CuО → СО2 + Cu СО +Fe2O3 → СО2 + Fe Получение: при температуре 500-8000С и недостатке кислорода. С + СО2 → СО (в газогенераторах и доменных печах, подземная газификация угля). Применение: 1) как топливо;
3) как сырье для органического синтеза. СО2 - оксид углерода (IV), углекислый газ. О=С=О – структурная формула. Газ без цвета и запаха, при 200С и 60 атм давления он превращается в жидкость. Если эту жидкость вылить быстро из сосуда, то она превратится в твердую снегообразную массу - «сухой лед». Твердый оксид углерода (IV) возгоняется (т.е. не плавясь переходит сразу в газообразное состояние) при -78,5 0С. Углекислый газ содержится в воздухе (около 0,04%), растворим в воде (при 180С 1:1), при понижении температуры и повышении давления растворимость увеличивается. Раствор углекислого газа в воде имеет кисловатый вкус, изменяет окраску индикатора, потому что происходит химическое взаимодействие: СО2↑ + H2O ↔ H2СО3, причем равновесие этой реакции сильно сдвинуто в сторону образования углекислого газа. Образующаяся кислота называется угольной. Т.е. углекислый газ – это кислотный оксид. Он взаимодействует с основными оксидами и основаниями: СО2↑+Na2O → Na2CO3 СО2↑+2Са(OH)2 → СаCO3↓ + H2O – эту реакцию используют как качественную, для определения углекислого газа. Здесь Са(OH)2 – насыщенный раствор гидроксида кальция, «известковая вода», при пропускании через нее углекислого газа появляется белый осадок. СО2↑+2NaOH → Na2CO3 + H2O или в избытке углекислого газа СО2↑+NaOH + H2O → NaHCO3 При высоких температурах СО2 проявляет окислительные свойства, например, магний горит в углекислом газе: Mg + CO2↑→ MgO + C Получение: 1) в промышленности при обжиге известняка СаСО3→ СаО + СО2↑ 2) в лаборатории – действуя соляной кислотой на мрамор или мел СаСО3 + HCl → СаCl2 + H2O + СО2↑ Применение. 1) производство карбонатов (сода, поташ и т.д.); 2) очистка сахара и других пищевых продуктов; 3) газирование воды; 4) тушение пожаров; 5) в переносных холодильниках (сухой лед). Угольная кислота и ее соли. H2СО3 - может существовать только в разбавленных растворах, т.е. равновесие смещено к оксиду и воде. СО2↑ + H2O ↔ H2СО3+ Q При нагревании равновесие еще больше смещается в сторону углекислого газа и, в конце концов, вся кислота разлагается, углекислый газ улетучивается и остается
|
||||
|
Последнее изменение этой страницы: 2016-04-26; просмотров: 1444; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.191.192.113 (0.013 с.) |

 1. Углерод как химический элемент.
1. Углерод как химический элемент.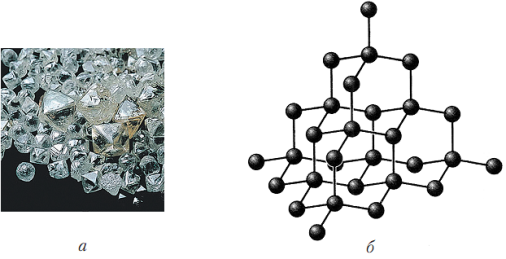 2. Простые вещества. Для углерода характерна аллотропия. Три основные модификации: алмаз, графит и аморфный углерод.
2. Простые вещества. Для углерода характерна аллотропия. Три основные модификации: алмаз, графит и аморфный углерод.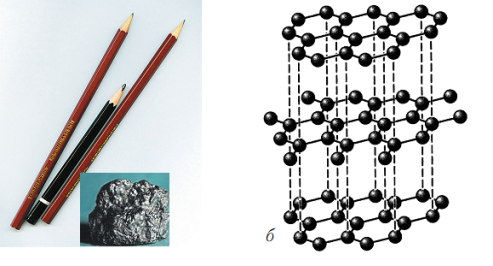 Алмаз: кристаллическая решетка – атомная, все четыре связи одинаковы и направлены к вершинам тетраэдра. Самое твердое вещество в природе, прозрачные бесцветные кристаллы, хрупкое, с высоким коэффициентом преломления света, плотность 3,5 г/см3, диэлектрик, не растворим. При нагревании до 1000-1500оС (без доступа воздуха) алмаз превращается в графит. Применяют алмазы в технике (для резки, бурения, шлифовки металлов, камня, стекла и т.д.), в ювелирном деле используют (около 10% от общей добычи). Графит: кристаллическая решетка – атомная, но связи не одинаковые, три из них находятся в одной плоскости и направлены к вершинам правильного треугольника. В результате получается решетка напоминающая пчелиные соты. Четвертая связь углерода не локализована. Поэтому графит имеет металлический блеск и хорошо проводит электрический ток и тепло. Он мягок, плотность 2,1-2,5 г/см3, структура слоистая, нерастворим в воде. Самая устойчивая при н.у. аллотропическая
Алмаз: кристаллическая решетка – атомная, все четыре связи одинаковы и направлены к вершинам тетраэдра. Самое твердое вещество в природе, прозрачные бесцветные кристаллы, хрупкое, с высоким коэффициентом преломления света, плотность 3,5 г/см3, диэлектрик, не растворим. При нагревании до 1000-1500оС (без доступа воздуха) алмаз превращается в графит. Применяют алмазы в технике (для резки, бурения, шлифовки металлов, камня, стекла и т.д.), в ювелирном деле используют (около 10% от общей добычи). Графит: кристаллическая решетка – атомная, но связи не одинаковые, три из них находятся в одной плоскости и направлены к вершинам правильного треугольника. В результате получается решетка напоминающая пчелиные соты. Четвертая связь углерода не локализована. Поэтому графит имеет металлический блеск и хорошо проводит электрический ток и тепло. Он мягок, плотность 2,1-2,5 г/см3, структура слоистая, нерастворим в воде. Самая устойчивая при н.у. аллотропическая 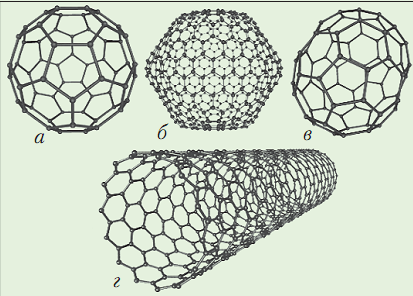 модификация. Графит можно превратить в алмаз при температуре около 3000оС и давлении порядка 100 000 атм. (1955г, США, Швеция). Применяют графит для изготовления электродов (аккумуляторы, гальвано-технологии и т.д.), как смазочный материал (при очень низких и очень высоких температурах), замедлитель нейтронов в АЭС, для рисования. В природе встречается достаточно часто, но этого технике не хватает. Графит получают из каменного угля при нагревании до 3000оС без доступа воздуха.
модификация. Графит можно превратить в алмаз при температуре около 3000оС и давлении порядка 100 000 атм. (1955г, США, Швеция). Применяют графит для изготовления электродов (аккумуляторы, гальвано-технологии и т.д.), как смазочный материал (при очень низких и очень высоких температурах), замедлитель нейтронов в АЭС, для рисования. В природе встречается достаточно часто, но этого технике не хватает. Графит получают из каменного угля при нагревании до 3000оС без доступа воздуха. При термическом разложении органических веществ получается «черный графит» или «аморфный углерод». Это вещество состоит из мельчайших кристаллов графита. Оно встречается в виде сажи или угля (древесного, каменного, животного, активированного)… Свойства угля зависят очень сильно от источника и способа получения. Древесный уголь, кокс используют в металлургии как восстановитель. Сажу используют как пигмент для красок и наполнитель для полимеров (резина). В медицине и технике широко используют активированный уголь. Так называют древесный уголь, поверхность которого обработана перегретым водяным паром. После такой обработки появляются на поверхности микропоры и площадь поверхности угля резко увеличивается. Активированный уголь обладает высокой адсорбционной способностью, что позволяет его использовать как хороший адсорбент в различных производствах, в т.ч. и в медицине.
При термическом разложении органических веществ получается «черный графит» или «аморфный углерод». Это вещество состоит из мельчайших кристаллов графита. Оно встречается в виде сажи или угля (древесного, каменного, животного, активированного)… Свойства угля зависят очень сильно от источника и способа получения. Древесный уголь, кокс используют в металлургии как восстановитель. Сажу используют как пигмент для красок и наполнитель для полимеров (резина). В медицине и технике широко используют активированный уголь. Так называют древесный уголь, поверхность которого обработана перегретым водяным паром. После такой обработки появляются на поверхности микропоры и площадь поверхности угля резко увеличивается. Активированный уголь обладает высокой адсорбционной способностью, что позволяет его использовать как хороший адсорбент в различных производствах, в т.ч. и в медицине. 1) горит синим пламенем, выделяя много тепла:
1) горит синим пламенем, выделяя много тепла: 2) как восстановитель в металлургии;
2) как восстановитель в металлургии; Т.е. в избытке кислоты (углекислого газа) средние соли превращаются в кислые, равновесие смещается к гидрокарбонатам. Чтобы сдвинуть равновесие к карбонатам – достаточно немного нагреть раствор. Этот процесс тем более важен, что все карбонаты (кроме солей щелочных металлов и аммония) – нерастворимы, а гидрокарбонаты – растворимы. Этот процесс играет очень важную роль в природе (процессы разрушения горных пород) и не менее важен для человека. На этом равновесии основана работа главной буферной системы организма – бикарбонатной.
Т.е. в избытке кислоты (углекислого газа) средние соли превращаются в кислые, равновесие смещается к гидрокарбонатам. Чтобы сдвинуть равновесие к карбонатам – достаточно немного нагреть раствор. Этот процесс тем более важен, что все карбонаты (кроме солей щелочных металлов и аммония) – нерастворимы, а гидрокарбонаты – растворимы. Этот процесс играет очень важную роль в природе (процессы разрушения горных пород) и не менее важен для человека. На этом равновесии основана работа главной буферной системы организма – бикарбонатной. CaCl2 + Na2CO3→ СаСО3↓ + 2NaCl
CaCl2 + Na2CO3→ СаСО3↓ + 2NaCl
 SiО2 - оксид кремния, кремнезем. Атомная кристаллическая решетка. Температура плавления около 17230С. В природе существует в виде крупных прозрачных кристаллов – горный хрусталь. Горный хрусталь, окрашенный примесями в лиловый цвет, называют аметистом, в бурый – дымчатым топазом.
SiО2 - оксид кремния, кремнезем. Атомная кристаллическая решетка. Температура плавления около 17230С. В природе существует в виде крупных прозрачных кристаллов – горный хрусталь. Горный хрусталь, окрашенный примесями в лиловый цвет, называют аметистом, в бурый – дымчатым топазом. Более мелкие кристаллы встречаются чаще, их называют кварцем, а очень мелкие кристаллы – кварцевым песком или кварцевой галькой. Скопления таких мелких кристаллов кварца встречаются в виде белой гальки, иногда она окрашена примесями в розовато-желтые тона.
Более мелкие кристаллы встречаются чаще, их называют кварцем, а очень мелкие кристаллы – кварцевым песком или кварцевой галькой. Скопления таких мелких кристаллов кварца встречаются в виде белой гальки, иногда она окрашена примесями в розовато-желтые тона. Кристаллы кварца имеют высокий коэффициент преломления света, пропускают ультрафиолетовые лучи, поэтому их используют в оптических приборах. Из них часто изготавливают ювелирные изделия, имитирующие (довольно успешно) бриллианты. А еще монокристаллы кварца обладают пьезоэлектрическим эффектом (т.е. эффект возникновения поляризации диэлектрика под действием механических напряжений (и наоборот)). Этот эффект используют в акустических приборах, пьезозажигалках и стиральных машинках…
Кристаллы кварца имеют высокий коэффициент преломления света, пропускают ультрафиолетовые лучи, поэтому их используют в оптических приборах. Из них часто изготавливают ювелирные изделия, имитирующие (довольно успешно) бриллианты. А еще монокристаллы кварца обладают пьезоэлектрическим эффектом (т.е. эффект возникновения поляризации диэлектрика под действием механических напряжений (и наоборот)). Этот эффект используют в акустических приборах, пьезозажигалках и стиральных машинках… Структура оксида кремния лежит и в основе полудрагоценных камней (агат, яшма), но структурные единицы в них расположены неупорядоченно, это аморфные или поликристаллические соединения. При охлаждении расплава оксида кремния образуется кварцевое стекло, в котором тетраэдрические элементы кремния тоже расположены неупорядоченно. Кварцевое стекло, в отличии от обычного, пропускает ультрафиолетовые лучи. Этот эффект мы используем в так называемых «кварцевых лампах». Кроме того, кварцевое стекло имеет очень маленький коэффициент расширения при нагревании. Т.е. стакан из такого стекла можно раскалить до красна и бросить в воду… Из этого стекла изготавливают химическую посуду. Мелкодисперсный аморфный кремнезем в природе образуется из остатков диатомовых водорослей и называется трепел. В промышленности такой кремнезем получают в виде мелких белых хлопьев и называют силикагелем. А прессованный в гранулы – гидрогелем. Используют его как адсорбент в медицине и не только в ней.
Структура оксида кремния лежит и в основе полудрагоценных камней (агат, яшма), но структурные единицы в них расположены неупорядоченно, это аморфные или поликристаллические соединения. При охлаждении расплава оксида кремния образуется кварцевое стекло, в котором тетраэдрические элементы кремния тоже расположены неупорядоченно. Кварцевое стекло, в отличии от обычного, пропускает ультрафиолетовые лучи. Этот эффект мы используем в так называемых «кварцевых лампах». Кроме того, кварцевое стекло имеет очень маленький коэффициент расширения при нагревании. Т.е. стакан из такого стекла можно раскалить до красна и бросить в воду… Из этого стекла изготавливают химическую посуду. Мелкодисперсный аморфный кремнезем в природе образуется из остатков диатомовых водорослей и называется трепел. В промышленности такой кремнезем получают в виде мелких белых хлопьев и называют силикагелем. А прессованный в гранулы – гидрогелем. Используют его как адсорбент в медицине и не только в ней. Нерастворимые силикаты широко распространены в природе в виде горных пород: полевые шпаты, глины, слюда, асбест, гранит, базальт, сланцы… Состав силикатов не соответствует формальной формуле, поэтому их обычно записывают несколько иначе, чем обычные соли. Например: не Na2SiO3 – а Na2О∙ SiО2, не СаSiO3 – а СаО∙SiО2. Тем более что природные силикаты – это обычно смесь кристаллогидратов нескольких силикатов, например калия и алюминия.
Нерастворимые силикаты широко распространены в природе в виде горных пород: полевые шпаты, глины, слюда, асбест, гранит, базальт, сланцы… Состав силикатов не соответствует формальной формуле, поэтому их обычно записывают несколько иначе, чем обычные соли. Например: не Na2SiO3 – а Na2О∙ SiО2, не СаSiO3 – а СаО∙SiО2. Тем более что природные силикаты – это обычно смесь кристаллогидратов нескольких силикатов, например калия и алюминия. полевой шпат – К2О∙ Al2O3∙6SiО2
полевой шпат – К2О∙ Al2O3∙6SiО2 5) в химических процессах – как адсорбенты и носители катализаторов.
5) в химических процессах – как адсорбенты и носители катализаторов.


