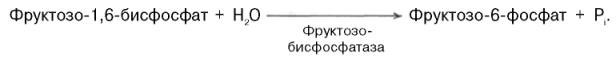Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Пентозофосфатный путь превращения глюкозыСодержание книги
Поиск на нашем сайте
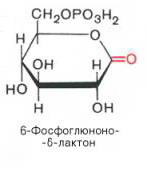
Пентозофосфатный путь – альтернативный путь окисления глюкозы. Его функции: - поставляет клеткам кофермент НАДФН, использующийся как донор водорода в реакциях восстановления; - обеспечивает клетки пентозофосфатами для синтеза нуклеотидов и нуклеиновых кислот. Пентозофосфатный путь не приводит к синтезу АТФ. Ферменты пути локализованы в цитозоле. Пентозофосфатный путь образования пентоз протекает в печени, жировой ткани, молочной железе, коре надпочечников, эритроцитах. В пентозофосфатном пути превращения глюкозы выделяют окислительный и неокислительный пути образования пентоз. Окислительный путь включает две реакции дегидрирования. Коферментом дегидрогеназ является НАДФ+, восстанавливающийся в НАДФН. Пентозы образуются при окислительном декарбоксилировании. Неокислительный путь включает реакции переноса 2- и 3-х углеродных фрагментов с одной молекулы на другую. Этот путь служит для синтеза пентоз. Процесс обратим, и из пентоз могут образовываться гексозы. 1). Дегидрирование глюкозо-6-фосфата при участии глюкозо-6-фос-фатдегидрогеназы и кофермента НАДФ+ с образованием 6-фосфоглюконо-d-лактона и НАДФН:
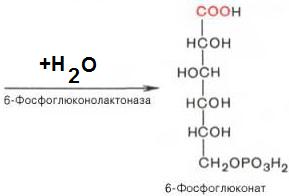
2). 6-фосфоглюконо-d-лактон нестабилен и гидролизуется с образованием 6-фосфоглюконата (фермент – 6-фосфоглюконолактоназа):
3). Дегидрирование и декарбоксилирование 6-фосфоглюконата с образованием рибулозо-5-фосфата (пентоза) и НАДФН при участии декарбоксилирующей 6-фосфоглюконатдегидрогеназы:
4). Под действием эпимеразы из рибулозо-5-фосфата образуется ксилулозо-5-фосфат (пентоза). Под влиянием изомеразы рибулозо-5-фосфат превращается в рибозо-5-фосфат (пентоза). Между формами пентозофосфатов устанавливается равновесие:
На этом этапе пентозофосфатный путь может быть завершен. При определенных условиях наступает неокислительная стадия пентозофосфатного цикла, протекающая анаэробно: образуются вещества, характерные для гликолиза (фруктозо-6-фосфат, фруктозо-1,6-бисфосфат, фосфотриозы), и вещества, специфические для пентозофосфатного пути (седогептулозо-7-фосфат, пентозо-5-фосфаты, эритрозо-4-фосфат). 5). Транскетолазная реакция взаимодействия ксилулозо-5-фосфата и рибозо-5-фосфата (кофермент – тиаминпирофосфат, переносит гликоальдегидную группу от ксилулозо-5-фосфата к рибозо-5-фосфату):
6). Транскетолазная реакция взаимодействия ксилулозо-5-фосфата и эритрозо-4-фосфата:
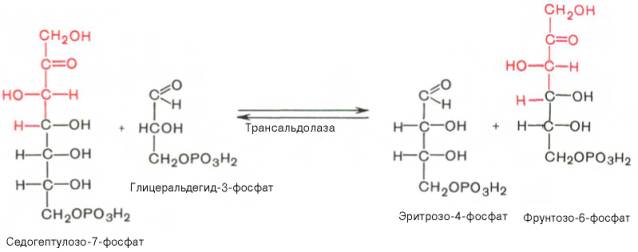
7). Трансальдолазная реакция – трансальдолаза катализирует перенос остатка диоксиацетона от седогептулозы-7-фосфата на глицеральдегид-3-фосфат:
Шесть молекул глюкозо-6-фосфата в пентозофосфатном цикле образуют 6 молекул рибулозо-5-фосфата и 6 молекул СО2. Из 6 молекул рибулозо-5-фосфата регенерируется 5 молекул глюкозо-6-фосфата: 6Глюкозо-6-фосфат + 7Н2О + 12НАДФ+ ® ® 5Глюкозо-6-фосфат + 6СО2 + Pi + 12НАДФН + 12Н+. Промежуточные продукты цикла (фруктозо-6-фосфат и глицеральдегид-3-фосфат) включаются в гликолиз.
ГЛЮКОНЕОГЕНЕЗ Глюконеогенез – синтез глюкозы из веществ неуглеводной природы, протекающий в основном в печени, и, менее интенсивно, – в корковом веществе почек и слизистой оболочке кишечника. Большинство реакций глюконеогенеза являются обратными гликолизу и катализируются теми же ферментами (рис. 41).
Рис. 41. Схема гликолиза и глюконеогенеза
Функция глюконеогенеза – поддержание уровня глюкозы в крови при длительном голодании и интенсивных физических нагрузках. Постоянное поступление глюкозы в качестве источника энергии особенно необходимо для нервной ткани и эритроцитов. Субстраты глюконеогенеза – ПВК, молочная кислота, глицерин, аминокислоты, метаболиты цикла Кребса. Их включение в глюконеогенез зависит от физиологического состояния организма. На примере синтеза глюкозы из пирувата рассмотрим подробно реакции, не являющиеся обратными реакциям гликолиза (гексокиназная (1), фосфофруктокиназная (3), пируваткиназная (10)). 1-ый этап – образование фосфоенолпирувата из ПВК. а) карбоксилирование ПВК под влиянием пируваткарбоксилазы с образованием оксалоацетата в митохондрии:
Пируваткарбоксилаза – митохондриальный фермент, аллостерическим активатором которого является ацетил-KоА. Для оксалоацетата митохондриальная мембрана непроницаема, поэтому оксалоацетат в митохондриях превращается в малатпри участии митохондриальной НАД-зависимой малатдегидрогеназы:
Малат выходит из митохондрии через митохондриальную мембрану в цитозоль, где под действием цитоплазматической НАД-зависимой малатдегидрогеназы окисляется в оксалоацетат:
б) в цитозоле клетки протекает декарбоксилирование и фосфорилирование оксалоацетата с образованием фосфоенолпирувата; фермент – фосфоенолпируваткарбоксикиназа:
2-ой этап – превращение фруктозо-1,6-бисфосфата во фруктозо-6-фосфат. Фосфоенолпируват в результате обратимых реакций гликолиза превращается во фруктозо-1,6-фосфат. Далее следует необратимая фосфофруктокиназная реакция гликолиза. Глюконеогенез идет в обход этой реакции:
3-ий этап – образование глюкозы из фруктозо-6-фосфата. Фруктозо-6-фосфат превращается в глюкозо-6-фосфат, который дефосфолирируется (реакция протекает в обход гексокиназной) под влиянием глюкозо-6-фосфатазы:
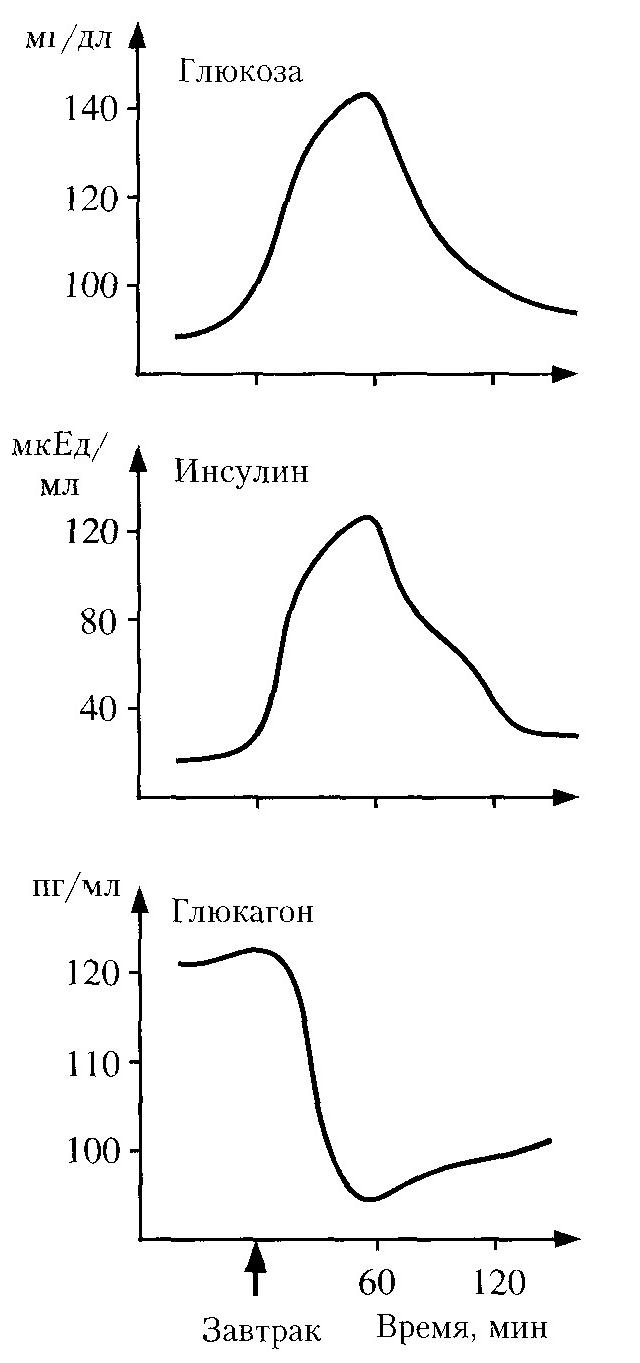
РЕГУЛЯЦИЯ ОБМЕНА УГЛЕВОДОВ Печень отличается наиболее сложным обменом глюкозы по сравнению с другими органами. В ней происходят противоположные процессы: синтез/распад гликогена и гликолиз/глюконеогенез. Направление метаболизма глюкозы в печени связано с ритмом питания. Переключение процессов синтеза и мобилизации гликогена в печени происходит при переходе состояния пищеварения в постабсорбтивный период или состояния покоя на режим мышечной работы. Абсорбтивным периодом называют период пищеварения. Постабсорбтивным называют период после завершения пищеварения до следующего приема пищи. В переключении этих метаболических путей в печени участвуют инсулин, глюкагон и адреналин, а в мышцах - инсулин и адреналин. Их влияние осуществляется путем изменения в противоположном направлении активности двух ключевых ферментов - гликогенсинтазы и гликогенфосфорилазы - с помощью фосфорилирования и дефосфорилирования. Инсулин и глюкагон постоянно присутствуют в крови, но при переходе из абсорбтивного состояния в постабсорбтивное изменяется их относительная концентрация (рис. 42) – инсулин-глюкагоновый индекс. В период пищеварения инсулин-глюкагоновый индекс повышается. Под влиянием инсулина стимулируется транспорт глюкозы в клетки мышечной ткани, изменяются активность и количество ферментов путем фосфорилирования и дефосфорилирования, индукция их синтеза. Введение инсулина вызывает понижение содержания глюкозы в крови, повышение запасов гликогена в мышцах. В постабсорбтивном периоде инсулин-глюкагоновый индекс снижается, и решающим фактором является влияние глюкагона, который стимулирует распад гликогена в печени. Механизм действия глюкагона включает каскад реакций, приводящий к активации гликогенфосфорилазы. Итогом является увеличение концентрации глюкозы в крови.
Биосинтез и секреция инсулина и глюкагона контролируются главным образом концентрацией глюкозы по принципу обратной связи. Повышение содержания глюкозы в крови вызывает увеличение секреции инсулина и замедление секреции глюкагона, а снижение, наоборот, замедление секреции инсулина и повышение – глюкагона. Этот контроль по типу обратной связи - один из важнейших механизмов регуляции содержания глюкозы в крови. Адреналин повышает уровень обмена углеводов в организме, усиливая распад гликогена в мышцах и ингибируя синтез гликогена из УДФ-глюкозы. Он вызывает резкое повышение уровня глюкозы в крови. Переключение печени с гликолиза на глюконеогенез и наоборот также происходит с участием инсулина и глюкагона и осуществляется с помощью: - аллостерических механизмов; - фосфорилирования/дефосфорилирования; - индукции/репрессии синтеза ключевых ферментов. Регуляция направлена на необратимые стадии гликолиза и глюконеогенеза. При уменьшении инсулин-глюкагонового индекса синтез ключевых ферментов гликолиза снижается, а ферментов глюконеогенеза (фосфоенолпируваткарбоксикиназа, фруктозо-6-фосфатаза, глюкозо-6-фосфатаза) - увеличивается, и стимулируется глюконеогенез. Направление реакций гликолиза регулируется содержанием глюкозы. При пищеварении концентрация глюкозы в крови возрастает до 10-20 мкмоль/л и активность глюкокиназы будет максимальной. Ускоряется гликолитическая реакция глюкоза → глюкозо-6-фосфат. Инсулин индуцирует синтез глюкокиназы и поэтому ускоряет фосфорилирование глюкозы. Важная роль в регуляции гликолиза и глюконеогенеза принадлежит фруктозо-2,6-бисфосфату. Фруктозо-2,6-бисфосфат образуется фосфорилированием фруктозо-6-фосфата при участии бифункционального фермента (БИФ). Этот фермент обладает двумя видами ферментативной активности:
Киназная активность проявляется при дефосфорилированной форме БИФ, которая характерна для абсорбтивного периода (инсулин-глюкагоновый индекс высокий). Увеличивается количество фруктозо-2,6-бисфосфата, который аллостерически активирует фосфофруктокиназу – гликолиз усиливается. Фруктозо-2,6-бисфосфат также ингибирует фосфатазу фруктозо-1,6-бифосфата (замедляется глюконеогенез). Фосфатазная активность проявляется при фосфорилированной форме БИФ (длительное голодание, инсулин/глюкагоновый индекс низкий): снижается количество фруктозо-2,6-бисфосфата, гликолиз замедляется и переключается на глюконеогенез. В период пищеварения инсулин активирует протеинфосфатазу, которая дефосфорилирует пируваткиназу и переводит ее в активное состояние: реакция фосфоенолпируват → пируват (гликолитическая) ускоряется при пищеварении и замедляется в постабсорбтивном периоде. Реакции глюконеогенеза пируват → оксалоацетат → фосфоенолпируват могут протекать при любом состоянии организма. В период пищеварения из-за ускорения начальных стадий гликолиза повышается содержание фруктозо-1,6-бисфосфата, что ведет к активации пируваткиназы (гликолиз усиливается). После приема пищи, богатой углеводами, инсулин-глюкагоновый индекс возрастает, увеличивается количество глюкокиназы, фосфофруктокиназы, пируваткиназы (гликолитические ферменты), и стимулируется гликолитический путь. Глюкоза в клетках печени используется также для энергообеспечения гепатоцитов. Основными потребителями АТФ в гепатоцитах являются трансмембранный перенос веществ, синтез белков, гликогена, жиров, глюконеогенез. АТФ и АМФ – аллостерические эффекторы некоторых гликолитических ферментов: АМФ активирует гексокиназу, фосфофруктокиназу и пируваткиназу и ингибирует фосфатазу фруктозо-1,6-бисфосфата. АТФ ингибирует фосфофруктокиназу и пируваткиназу. Т.о., при расходовании АТФ (растет концентрация АМФ) активируются гликолиз и синтез АТФ, глюконеогенез замедляется.
|
||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-07-14; просмотров: 461; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.117.72.244 (0.007 с.) |