Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Влияние на ферменты активаторов и ингибиторов.Содержание книги
Поиск на нашем сайте
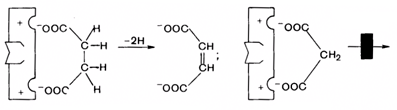
Активаторами ферментов являются катионы многих металлов, так, ионы кальция активируют липазу. Некоторые анионы также способны активировать ферменты: ионы хлора активируют a-амилазу слюны. Активаторами ферментов могут являться различные органические вещества (желчные кислоты пувеличивают активность фермента панкреатической липазы). Ингибиторы тормозят действие ферментов. По характеру своего действия ингибиторы подразделяются на обратимые и необратимые. В основе такого деления лежит прочность связи, образуемой между ингибитором и ферментом. Обратимые ингибиторы - соединения, которые нековалентно взаимодействуют с ферментом и могут отделяться от фермента. Обратимое ингибирование может быть конкурентным. Конкурентный ингибитор имеет структуру, похожую на структуру субстрата, но несколько от нее отличающуюся. Он конкурирует с субстратом за связывание в субстратсвязывающем участке активного центра. Конкурентный ингибитор увеличивает Кm. Пример: фермент сукцинатдегидрогеназа катализирует дегидририрование сукцината; продуктом реакции является фумарат. Малонат,структурно сходный с сукцинатом, связывается в активном центре фермента, но не способен дегидрироваться (рис. 24).
Рис. 24. Схема конкурентного ингибирования
Степень торможения определяется соотношением концентраций малоната и сукцината. При высокой концентрации субстрата последний может полностью вытеснять ингибитор из активного центра, поэтому umax не изменяется. Метод конкурентного торможения широко применяется в медицинской практике. Парааминобензойная кислота – соединение, участвующее в метаболизме бактерий. Сульфаниламиды – препараты, используемые для лечения инфекционных болезней, – являются ее структурными аналогами. Сульфаниламид вытесняет пара-аминобензойную кислоту из комплекса с ферментом, что приводит к гибели микроорганизмов. При обратимом неконкурентном ингибировании субстрат и ингибитор связываются с разными центрами. Увеличение концентрации субстрата не препятствует связыванию ингибитора. Неконкурентный ингибитор уменьшает umax, а Кm не меняется. Известно бесконкурентное ингибирование: ингибитор связывается с ферментом не в каталитическом центре только с ES-комплексом в виде тройного комплекса. Бесконкурентный ингибитор увеличивает Кm и уменьшает umax. Необратимые ингибиторы - соединения, которые могут специфически связывать функционально важные группы активного центра, образуя ковалентные прочные связи с ферментом. Любые агенты, вызывающие денатурацию белка, приводят к необратимой инактивации фермента, но она не связана с механизмом действия ферментов. Неконкурентное необратимое ингибирование вызывается солями тяжелых металлов (ртуть, свинец и др.), которые блокируют HS-группы полипептидной цепи, оксидом углерода (II), цианидами и др. При конкурентном необратимом торможении ингибитор, обладающий структурным сходством с субстратом, соединяется с ферментом, подменяя собой субстрат. Диизопропилфторфосфат является структурным аналогом нейромедиатора ацетилхолину и способен присоединяться к активному центру фермента ацетилхолинэстеразы, гидролизующего ацетилхолин. Он блокирует активный центр фермента, и в результате утрачивается способность нейронов проводить нервные импульсы. Химическая модификация фермента. Регуляция активности ферментов путем фосфорилирования-дефосфорилирования. Осуществляется при участии протеинкиназ. Фосфорилирование возможно по ОН-группам серина и треонина, а в ряде случаев – тирозина. Активностью может обладать как фосфорилированная, так и дефосфорилированная форма. Например, фермент липаза активируется путем фосфорилирования. Регуляция активности путем ассоциации-диссоциации субъединиц в олигомерном ферменте. Например, фермент протеинкиназа в неактивной форме является тетрамером. Для активации протеинкиназы необходима диссоциация субъединиц. Активация ферментов путем частичного протеолиза. Некоторые ферменты синтезируются неактивными и только после секреции из клетки активируются путем удаления фрагмента белковой молекулы. Так осуществляется активация протеолитических ферментов, в частности, трипсина. Аллостерическая регуляция. Во многих случаях главным типом регуляции скорости многостадийного ферментативного процесса является ингибирование по принципу обратной связи. Конечный продукт подавляет активность фермента, катализирующего первую стадию синтеза, которая является ключевой для данной цепи реакции. Он связывается с аллостерическим центром молекулы фермента. Это ингибирование по принципу обратной связи, или ретроингибирование.
|
||||
|
Последнее изменение этой страницы: 2016-07-14; просмотров: 758; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.116.24.238 (0.005 с.) |