
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Кинетика ферментативных реакцийСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Ферментативная кинетика исследует влияние химической природы реагирующих веществ (ферментов, субстратов) и условий их взаимодействия (рН среды, температура, концентрация, присутствие активаторов или ингибиторов) на скорость ферментативной реакции. Скорость ферментативной реакции (u) измеряют по убыли количества субстрата или приросту продукта реакции за единицу времени. При низкой концентрации субстрата скорость реакции
прямо пропорциональна его концентрации. При высокой концентрации субстрата, когда все активные центры фермента заняты субстратом (насыщение фермента субстратом), скорость реакции максимальна, становится постоянной и не зависящей от концентрации субстрата [S] и полностью зависит от концентрации фермента (рис. 19). KS – константа диссоциации фермент-субстратного комплекса ES, обратна константе равновесия:
Чем меньше значение KS, тем выше сродство фермента к субстрату.
Количественное соотношение между концентрацией субстрата и скоростью ферментативной реакции выражает уравнение Михаэлиса-Ментен:
u - скорость реакции, umax - максимальная скорость ферментативной реакции. Бриггс и Холдейн усовершенствовали уравнение, введя в него константу Михаэлиса Km, определяемую экспериментально. Уравнение Бриггса – Холдейна:
где
Константа Михаэлиса численно равна концентрации субстрата (моль/л), при которой скорость ферментативной реакции составляет половину от максимальной (рис. 20). Кm показывает сродство фермента к субстрату: чем меньше ее значение, тем больше сродство.
Экспериментальные значения Кm для большинства ферментативных реакций с участием одного субстрата обычно 10-2-10-5 М. Если реакция обратима, то взаимодействие фермента с субстратом прямой реакции характеризуется Кm, отличающейся от таковой для субстрата обратной реакции. Г. Лайнуивер и Д. Берк преобразовали уравнение Бриггса – Холдейна и получили уравнение прямой линии: у = ах + b (рис. 21):
Метод Лайнуивера – Берка дает более точный результат.
Рис. 21. Графическое определение константы Михаэлиса по методу Лайнуивера-Берка
СВОЙСТВА ФЕРМЕНТОВ Ферменты отличаются от обычных катализаторов рядом свойств. Термолабильность, или чувствительность к повышению температуры (рис. 22).
Рис. 22. Зависимость скорости ферментативной реакции от температуры При температуре, не превышающей 45–50 °С, скорость большинства биохимических реакций повышается в 2 раза при повышении температуры на 10 °С согласно правилу Вант-Гоффа. При температуре выше 50 °С на скорость реакции влияниет тепловая денатурация белка-фермента, постепенно приводящая к его полной дезактивации. Температура, при которой каталитическая активность фермента максимальна, называется его температурным оптимумом. Температурный оптимум для большинства ферментов млекопитающих находится в пределах 37-40 °С. При низких температурах (0 °С и ниже) ферменты, как правило, не разрушаются, хотя активность их снижается практически до нуля. Зависимость активности фермента от значения рН среды (рис. 23). Для каждого фермента существует оптимальное значение рН среды, при котором он проявляет максимальную активность. рН-оптимум действия ферментов животных тканей лежит в пределах узкой зоны концентрации водородных ионов, соответствующей выработанным в процессе эволюции физиологическим значениям рН среды 6,0-8,0. Исключения составляют пепсин – 1,5-2,5; аргиназа – 9,5-10.
Влияние изменений рН среды на молекулу фермента заключается в воздействии на степень ионизации его активных групп, а, следовательно, на третичную структуру белка и состояние активного центра. рН меняет также ионизацию кофакторов, субстратов, фермент-субстратных комплексов и продуктов реакции. Специфичность. Высокая специфичность действия ферментов обусловлена конформационной и электростатической комплементарностью между молекулами субстрата и фермента и уникальной структурной организацией активного центра, обеспечивающими избирательность протекания реакции. Абсолютная специфичность – способностьфермента катализировать единственную реакцию. Например, уреаза катализирует реакцию гидролиза мочевины до NH3 и СО2, аргиназа – гидролиз аргинина. Относительная (групповая) специфичность – способность фермента катализировать группу реакций определенного типа. Относительной специфичностью, например, обладают гидролитические ферменты пептидазы, гидролизующие пептидные связи в молекулах белков и пептидов, липаза, гидролизующая сложноэфирные связи в молекулах жиров. Стереохимической специфичностью обладают ферменты, катализирующие превращения только одного из пространственных изомеров. Фермент фумараза катализирует превращение транс-изомера бутендиовой кислоты - фумаровой кислоты в яблочную, и не действует на цис-изомер - малеиновую кислоту. Высокая специфичность действия ферментов обеспечивает протекание лишь определенных химических реакций из всех возможных превращений.
|
||||||||||
|
Последнее изменение этой страницы: 2016-07-14; просмотров: 1259; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.226.222.76 (0.007 с.) |


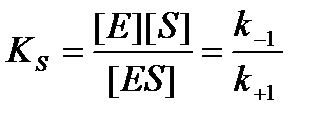 .
.
 ,
, ,
,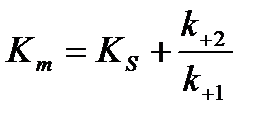 .
.
 .
.





