
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Влияние катализатора на скорость реакции.Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте Одним из способов увеличения скорости реакции является снижение энергетического барьера, то есть уменьшение Действие катализатора специфично и обусловлено природой катализатора, его физическими свойствами и способом предварительной обработки. Катализ – изменение скорости химической реакции веществами (катализаторами), которые участвуют в промежуточных стадиях реакции, но не входят в состав конечных продуктов. В зависимости от того, находится ли катализатор в той же фазе, что и реагирующие вещества, или образует самостоятельную фазу, говорят о гомогенном или гетерогенном катализе. Механизм каталитического действия для них не одинаков, однако и в том и в другом случае происходит ускорение реакции за счет снижения Ea (рис. 6 ). Каталитическое действие также зависит от концентрации введенного катализатора. Активность катализатора в гетерогенном катализе зависит не только от его природы, но и от величины поверхности. В связи с этим катализатор должен обладать либо пористой структурой, либо находиться в высокодисперсном состоянии. Активность катализатора в данном случае обусловлена избыточной поверхностной энергией за счет дефектов кристаллической решетки.
Е, кДж Еа
Е/а А+Б С+Д Координата реакции
Рис. 6. Влияние катализатора на энергию активации реакции: 1 – без катализатора (
Общие закономерности каталитических реакций: - катализатор обладает специфичным, избирательным действием - катализирует только энергетически возможные реакции (ΔG< 0) - ускоряет как прямую, так и обратную реакцию в одинаковое число раз - не расходуется в реакции, изменяет число и характер элементарных стадий. Особенности ферментативных реакций: - особо высокая специфичность действия (только на один изомер, на определенные химические связи), которые зависят от структуры субстрата - каталитическая активность намного превосходит активность неорганических катализаторов (1 моль неорганического катализатора – Fe2+ за 1 сек при температуре 0 0С разлагает 10-5 моль Н2О2, а такое же количество фермента – каталазы при той же температуре за то же время разлагает 105 моль Н2О2) - скорость ферментативного катализа намного выше неорганического - ферменты катализируют реакции в «мягких» условиях (рН≈7, t=37 0С, р=101,3 кПа) - уникальное свойство ферментов – регулируемая активность, позволяющая изменять скорость превращений в организме в зависимости от условий - скорость ферментативной реакции прямо пропорциональна количеству фермента - действие ферментов зависит от присутствия специфических активаторов и ингибиторов - локализация ферментов в определенных субклеточных структурах. Поэтому в биотехнологии практикуется иммобилизация – закрепление фермента на носителях (целлюлоза и ее производные, гель полиакриламида, сефадексы, нейлон, крахмал, коллодий, алюмосиликаты, оксиды металлов и др.)
ХИМИЧЕСКОЕ РАВНОВЕСИЕ Различают обратимые и необратимые реакции. Необратимыми реакциями называются такие, после протекания которых, систему и внешнюю среду одновременно нельзя вернуть в прежнее состояние. Они идут в одном направлении до полного расходования одного из реагирующих веществ.
Многие химические реакции являются обратимыми, т.е. одновременно протекают в двух противоположных направлениях и не доходят до конца. Особенность обратимых реакций состоит в том, что по мере накопления продуктов реакции возрастает скорость обратной реакции. Если они сравняются, то наступает равновесное состояние.
Химическое равновесие характеризуется константой химического равновесия Для реакции аА + вВ «сС + dD, из ЗДМ следует:
где
Константа химического равновесия может быть рассчитана из изотермы Вант-Гоффа при
следовательно Константа равновесия имеет большое теоретическое значение и практическое значение. По ее величине можно судить о полноте протекания реакции. Если
|
||
|
Последнее изменение этой страницы: 2016-08-26; просмотров: 1071; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.41 (0.009 с.) |

 . Это достигается введением катализаторов. Катализатор – вещество, влияющее на скорость реакции, но к концу реакции остаются химически неизменными. Вещества, ускоряющие химический процесс, называются положительными катализаторами, замедляющие – отрицательными (ингибиторами). На применении катализаторов основано получение большинства продуктов химического производства. Каталитическое действие является основой жизнедеятельности и в природе. Все химические превращения в организмах инициируются особыми катализаторами – ферментами.
. Это достигается введением катализаторов. Катализатор – вещество, влияющее на скорость реакции, но к концу реакции остаются химически неизменными. Вещества, ускоряющие химический процесс, называются положительными катализаторами, замедляющие – отрицательными (ингибиторами). На применении катализаторов основано получение большинства продуктов химического производства. Каталитическое действие является основой жизнедеятельности и в природе. Все химические превращения в организмах инициируются особыми катализаторами – ферментами. = 157 кДж/моль); 2 – с катализатором (
= 157 кДж/моль); 2 – с катализатором ( = 62 кДж/моль)
= 62 кДж/моль) прямой р-ии >>
прямой р-ии >>  обратной р-ии
обратной р-ии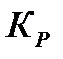 .
. (51)
(51) и
и  - константы скоростей прямой и обратной реакций,
- константы скоростей прямой и обратной реакций,  - равновесные концентрации веществ соответственно. В условиях равновесия концентрации всех реагентов связаны друг с другом, и изменение одной из них вызовет изменение других, только соотношение равновесных концентраций останется постоянным при данной температуре.
- равновесные концентрации веществ соответственно. В условиях равновесия концентрации всех реагентов связаны друг с другом, и изменение одной из них вызовет изменение других, только соотношение равновесных концентраций останется постоянным при данной температуре. - константа равновесия – определяется отношением произведений равновесных концентраций продуктов реакции на произведение равновесных концентраций исходных веществ, взятых в степенях их стехиометрических коэффициентов. В выражение константы равновесия входят только концентрации газообразных и растворенных веществ.
- константа равновесия – определяется отношением произведений равновесных концентраций продуктов реакции на произведение равновесных концентраций исходных веществ, взятых в степенях их стехиометрических коэффициентов. В выражение константы равновесия входят только концентрации газообразных и растворенных веществ.  =0, являющейся термодинамическим условием химического равновесия:
=0, являющейся термодинамическим условием химического равновесия: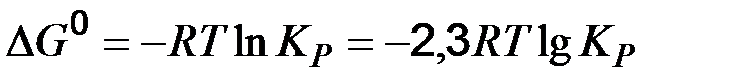 (52)
(52)



