
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Механизм гидролиза по аниону.Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте 1. Анионы, обладающие высоким поляризующим действием: сульфид, карбонат, ацетат, сульфит, фосфат, цианид, силикат – анионы слабых кислот. У них вакантной орбитали нет, работает избыточный отицательный заряд.
Анион, обладающий хорошо выраженной донорной способностью. Донор вызывает поляризацию гидратной оболочки. Результат поляризации – изменение рН > 7 (щелочная) 2. Анионы, не способные поляризовать гидртную оболочку (водородная связь не превращается в ковалентную, отрыва иона Н+ не наблюдается). Это слабые доноры электронной пары, поэтому взаимодействия между молекулами воды и анионом не будет. Это анионы сильных кислот: хлорид, бромид, сульфат, нитрат, перхлорат. рН вменятся не будет. Количественной характеристикой гидролиза является степень гидролиза и константа гидролиза. 1. Гидролиз обратим, существует равновесие. Для любой равновесной системы справедлив ЗДМ, по которому можно определить Кр. Произведение Кр и концентрации воды – есть Кгидролиза. 2. Степень гидролиза (h) – отношение количества соли, подвергшиеся гидролизу, к общему количеству растворенной соли. Она изменяется, не табличная величина.
Связь между константой гидролиза и степенью гидролиза выражаются соотношением:
Из формулы видно, что степень гидролиза увеличивается при разбавлении раствора, она также увеличивается при повышении температуры. Примеры гидролиза: 1. Кат и Ан не поляризуют гидратную оболочку (Соль сильной кислоты и сильной щелочи). NaCl + HOH = NaOH + HCl Na+ + Cl- + HOH = Na+ + OH- + H+ + Cl- HOH = OH- + H+ (смещение равновесия ←) Вывод: гидролиз не протекает, рН не меняется (рН=7). 2. Кат не поляризует гидратную оболочку, а Ан обладает поляризующим действием (Соль слабой кислоты и сильной щелочи). CH3COONa + HOH = CH3COOH + NaOH CH3COO- + HOH + Na+ = CH3COOH + OH- + Na+ CH3COO- + HOH = CH3COOH + OH- Тогда:
Гидролиз многозарядных ионов протекает ступенчато CO32- + HOH ↔ HCO3- + OH- 1-я ступень HCO3- + HOH ↔ CO2∙H2O + OH- 2-я ступень практически не протекает. В выражение константы гидролиза подставляется константа ионизации той стадии, на которой получен гидролизующийся ион. Чем меньше константа ионизации, тем больше константа гидролиза. Чем слабее образующееся кислота, тем полнее протекает гидролиз. Вывод: протекает обратимый гидролиз (по аниону), рН меняется, рН>7 (щелочная). 3. Ан не поляризует гидратную оболочку, а Кат обладает поляризующим действием (Соль сильной кислоты и слабого основания). AlСl3 + HOH ↔ AlOHCl2 + HCl 1-я ступень гидролиза Al3+ + HOH + 3Cl- = AlOH2+ + 2Cl- + H+ + Cl- Al3+ + HOH = AlOH2+ + H+ 2-я и 3-я ступень практически не протекают вследствие обратимости процесса.
Вывод: протекает обратимый гидролиз (по катиону), рН меняется, рН<7 (кислая). 4. Ан и Кат поляризуют гидратную оболочку (обладают поляризующим действием) (Соль слабой кислоты и слабого основания). Al2(CO3)3 + 6HOH → 2Al(OH)3↓ + 3H2CO3 2Al3+ + 3CO32- + 6HOH → 2Al(OH)3↓ + 3CO2↑ + 3HOH
Вывод: гидролиз необратим, протекает ступенчато, полностью. рН ≈ 7. При одновременном гидролизе катиона и аниона рН определяется более сильным электролитом – с большей Кд и меньшим рК: CH3COONH4 + HOH → NH3·H2O + CH3COOH Kb=1,8·10-5 Кa=1,86·10-5 => рН ≈ 7 (NH4)2S + HOH → NH3·H2O + H2S Kb=1,8·10-5 Кa =5, 6·10-12 => рН > 7 Факторы, влияющие на смещение химического равновесия процесса гидролиза (согласно принципу Ле-Шателье): 1. Так как гидролиз процесс эндотермический (ΔΗ>0), то повышение температуры увеличивает процесс гидролиза (равновесие смещается вправо). 2. Разбавление раствора водой способствует протеканию процесса, связанного с его поглощением, т.е. усилению гидролиза. 3. Введение разноименных ионов также усиливает гидролиз. К2СО3 + Н2О = 2КОН + Н2СО3 2К+ + СО32- + Н2О = 2К+ + 2ОН- + Н2СО3 СО32- + Н2О = 2ОН- + Н2СО3, введение Н+ связывает ОН- в воду и тем самым смещает равновесие вправо. 4. При добавлении кислоты к раствору соли кислой среды или добавлении щелочи к раствору соли щелочной среды гидролиз подавляется за счет увеличения концентрации одного из продуктов реакции (равновесие смещается влево – введение одноименных ионов) К2СО3 + Н2О = 2КОН + Н2СО3 2К+ + СО32- + Н2О = 2К+ + 2ОН- + Н2СО3 СО32- + Н2О = 2ОН- + Н2СО3, введение ОН- смещает равновесие влево. Рассматривая поведение кислых и основных солей в растворе, следует учитывать как процессы ионизации, так и процессы гидролиза. Например, NaH2PO4 и PbOHCl подвергаются: а) первичной ионизации ионизации, которая протекает практически полностью: NaH2PO4 ↔ Na+ + H2PO4- PbOHCl ↔ PbOH+ + Cl- б) вторичной ионизации сложных ионов: H2PO4- ↔ Н+ + НРО42- PbOH+ ↔ Pb2+ + OH- в) и гидролизу сложных ионов: H2PO4- + НОН ↔ Н3РО4 + ОН- PbOH+ + HOH ↔ Pb(OH)2 + H+ Процессы а) определяют исходную концентрацию сложных ионов в растворе; последняя будет, очевидно, равна концентрации соли, поскольку соли – сильные электролиты. Процессы б) и в) определяют равновесную концентрацию простых и сложных ионов в растворе, а также концентрацию Н+ и ОН-. Чтобы определить, какую реакцию исеет раствор кислой соли, например, NaH2PO4, кислую или щелочную, следует определить, какой процесс протекает в большей степени: ионизация (б) или гидролиз (в). Для этого надо сравнить константу ионизации H2PO4- с константой гидролиза этого иона:
Кион > КГ, в растворе будет преодладать процесс ионизации, поэтому рН < 7 (среда кислая). В расчетах необходимо придерживаться правилом: в константу гидролиза подставляется ионизации той стадии, на которой появился данный ион, подвергающийся гидролизу. Н3РО4 ↔ Н2РО4- + Н+ (I стадия).
10.2. Контрольные вопросы и задания 1. Что называется ионным произведением воды? Чему оно равно? 2. Что такое рН раствора? Какой раствор называется нейтральным, щелочным, кислым? 3. Определите рН, если [H+] = 2·10-5 моль/дм3. 4. Определите [H+] в растворе, если рН = 5,4. 5. Что такое буферный раствор, буферная емкость? Значение буферных растворов в медицине и фармации. 6. Что называется гидролизом? Механизм гидролиза. Гидролиз аквакатионов. Гидролиз анионов. Совместный гидролиз (катиона и аниона). 7. Катионы и анионы как сопряженные кислота и основание. 8. Как можно провести гидролиз до конца и наоборот, замедлить процесс гидролиза? Какой принцип из ранее изученных тем следует здесь применить? 9. Степень и константа гидролиза (определение, расчет). 10. Значение гидролиза и применение его в медицине и фармации.
Примеры решения задач Пример 1. Концентрация ионов водорода в растворе равна 4 · 10-3 моль/дм3. Определите рН раствора. Решение. рН = -lg[H+] = -lg 4 · 10-3 = -(-3 + 0,6) = 2,4 Пример 2. Определите концентрацию ионов водорода в растворе, рН которого 4,6. Решение. –lg[H+] = 4,6, следовательно, по таблице логарифмов находим: [H+] = 2,5 · 10-5 моль/дм3. Пример 3. Определите концентрации НСО3- и СО32- в 0,01 М растворе угольной кислоты, если рН этого раствора равен 4,18. Решение. Находим концентрацию ионов водорода в растворе: -lg[H+] = 4,18, по таблице логарифмов находим: [H+] = 6,61 · 10-5 моль/дм3. Н2СО3 ↔ Н+ + НСО3- Находим [HCO3-] = 4,45 · 10-7 · 0,01 / 6,61 · 10-5 = 6,73 · 10-5 моль/дм3. НСО3- ↔ Н+ + СО32- Находим [CO32-] = 4,69 · 10-11 · 6,73 · 10-5 / 6,61 · 10-5 = 4,48 · 10-11 моль/дм3. Пример 4. Составьте ионно-молекулярные и молекулярные уравнения гидролиза солей: а) KCN; б) Na2CO3; в) ZnSO4. определите реакцию среды растворов этих солей. Решение. KCN – соль слабой синильной кислоты и сильного основания. Поэтому гидролиз протекает по аниону. В результате гидролиза в растворе появляется избыток гидроксид-ионов. Раствор KCN имеет щелочную реакцию (рН>7): KCN + НОН ↔ НCN + КОН K+ + CN- + НОН ↔ НCN + К+ + ОН- CN- + НОН ↔ НCN + ОН- Na2CO3 – соль слабой угольной кислоты и сильного основания. Поэтому гидролиз протекает по аниону. В результате гидролиза в растворе появляется избыток гидроксид-ионов. Раствор Na2CO3 имеет щелочную реакцию (рН>7): Na2CO3 + НОН ↔ NaНCO3 + NaОН 2Na+ + CO32- + НОН ↔ Na+ + НCO3- + Na+ + ОН- CO32- + НОН ↔ НCO3- + ОН- ZnSO4 – соль сильной серной кислоты и слабо многокислотного основания Zn(ОН)2. Поэтому гидролиз протекает по катиону. В результате гидролиза в растворе появляется избыток ионов водорода. Раствор ZnSO4 имеет кислую реакцию (рН<7): 2ZnSO4 + 2НОН ↔ (ZnОН)2SO4 + Н2SO4 2Zn2+ + 2SO42- + НОН ↔ 2ZnОН+ + SO42- + 2Н+ + SO42- 2Zn2+ + НОН ↔ 2ZnОН+ + 4Н+ Пример 5. Какие продукты образуются при смешивании растворов Al(NO3)3 и К2СО3? Составьте ионно-молекулярное и молекулярное уравнения реакции. Решение. Al(NO3)3 подвергается гидролизу по катиону. К2СО3 подвергается гидролизу по аниону. Если эти растворы находятся в одном сосуде, то идет взаимное усиление гидролиза, т.к. ионы Н+ и ОН- образуют молекулу слабого электролита – Н2О. Реакция гидролиза смещается вправо, идет необратимо в сторону образования продуктов гидролиза: 2 Al(NO3)3 + 3 К2СО3 + 3 НОН → 2 Al(ОН)3↓ + 3 СО2↑ + 6 КNO3 2 Al3+ + 6NO3- + 6К+ + 3СО32- + 3НОН → 2Al(ОН)3↓ + 3СО2↑ + 6К+ + 6NO3- 2 Al3+ + 3СО32- + 3НОН → 2Al(ОН)3↓ + 3СО2↑ Пример 6. Вычислите константу гидролиза, степень гидролиза и рН ацетата калия в 0,1 М растворе. Решение. Гидролиз идет по аниону: СН3СОО- + НОН →СН3СООН + ОН- Ка(СН3СООН) = 1,8· 10-5 (табл. величина)
Для вычисления рН следует принять во внимание, что в результате гидролиза каждого ацетат иона образуется один гидроксид ион. Если исходная концентрация гидролизующихся анионов С моль/л, а гидролизу подвергалась доля этих анионов, то при этом образовалось С моль/л ионов ОН-, т.е. [OH-] = h· C = 7,5 · 10-5 · 0,1 = 7,5 · 10-6 моль/л рОН = - lg[OH] = - lg 7,5 · 10-6 = - (-6 + 0,88) = 5,12 Отсюда рН = 14 – рОН = 14 – 5,12 = 8,88. 10.4. Индивидуальные задания Задание. Решите задачи своего варианта (табл. 52). Таблица 52 Варианты контрольного задания
Продолжение табл. 52
Продолжение табл. 52
Продолжение табл. 52
Окончание табл. 52
10.5. Тестовые задания 1. Водородный показатель раствора равен двум, тогда аН+ (моль/дм3) равна: а) 0,1 б) 0,01 в) 0,02 г) 0,001 2. Система обладает буферным действием: а) NaCH3COO + CH3COOH г) NH4Cl + H2O б) HCl + CH3COOH в) CH3COONH4 + NaCl 3. При разбавлении буферной системы водой в 2 раза, его емкость: а) увеличилась в 2 раза в) уменьшается в 2 раза б) увеличилась в 0,2 раза г) не изменилась 4. Гидролизу не подвергается: а) глюкоза в) этилацетат б) крахмал г) белок 5. Соль подвергающаяся гидролизу по катиону: а) CaBr2 б) Ba(NO3)2 в) Na2SO3 г) AlCl3 6. Соль подвергающаяся гидролизу по аниону: а) CaBr2 б) Ba(NO3)2 в) Na2SO3 г) AlCl3 7. Кислотность почвы увеличится при обработке раствором соли: а) NH4NO3 б) NaNO3 в) NaCl г) Na2SO4 8. рН = 7 имеет водный раствор соли: а) NaNO3 б) (NH4)2SO4 в) FeSO4 г) Na2S 9. Вещества, которые диссоциируют только на катионы металла и гидроксид-ионы: а) кислоты б) щелочи в) соли г) амфотерные гидроксиды 10. Сильный электролит раствор: а) СО2 б) О2 в) H2S г) H2SO4 ПРИЛОЖЕНИЕ 1 Объем учебной дисциплины «Общая и неорганическая химия» и виды учебной работы для студентов очного отделения фармацевтического факультета
Календарный план лабораторных занятий по общей и неорганической химии для студентов дневного отделения фармацевтического факультета I семестр (продолжительность - 5 часов)
Календарный план лекций по общей и неорганической химии для студентов дневного отделения фармацевтического факультета I семестр (продолжительность - 2 часа)
ПРИЛОЖЕНИЕ 2
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-08-26; просмотров: 733; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.142.250.57 (0.014 с.) |


 (81)
(81) (82)
(82)


 (83)
(83) (84)
(84) (85)
(85) (86)
(86) (87)
(87) (88)
(88)

 , где КW – ионное произведение воды.
, где КW – ионное произведение воды.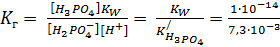 = 1,33·10-12
= 1,33·10-12 - константа ионизации Н3РО4 по I ступени. Равна 7,3·10-3 (прилож. 7).
- константа ионизации Н3РО4 по I ступени. Равна 7,3·10-3 (прилож. 7). (табл. величина).
(табл. величина). (табл. величина).
(табл. величина). ;
; 



