
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Методика расчёта pH в растворах средних гидролизующихся солейСодержание книги
Поиск на нашем сайте
Рассмотрим методику расчёта pH в растворах гидролизующихся солей. Равновесные концентрации участников процесса гидролиза по каждой ступени (вода не учитывается) связаны друг с другом через соответствующую константу гидролиза Кг, которую рассчитывают по следующему правилу: константа гидролиза Кг равна частному от деления ионного произведения воды Кw = 10–14 на константу диссоциации Ка слабой кислоты (Кb слабого основания), которые образовались в результате гидролиза. Пример. Слабая фосфорная кислота диссоциирует по трем ступеням: H3PO4 → H2PO4– → HPO42– → PO43– константы диссоциации Kа1 Kа2 Kа3 при этом образуются три типа анионов, способных к гидролизу. Ион PO43– гидролизуется по трем ступеням и каждая из них имеет свою константу гидролиза: PO43- → HPO42- → H2PO4- → H3PO4. Константа гидролиза: Kг1 = Кw / Ка3; Kг2 = Кw / Ка2; Kг3 = Кw / Ка1. В качестве примера рассмотрим простейший случай расчета pH в растворе средней соли, например, фосфата натрия с молярной концентрацией с0 моль/л. Na3PO4 → 3Na+ + PO43– с0 3с0 с0 Обозначим степень гидролиза иона PO43– по первой ступени через h1 (h1<<1), тогда к моменту установления равновесия подверглось гидролизу сгидр. (PO43–) = h1 ·с0 и PO43– + H2O ↔ HPO42– + OH– до гидролиза с0 моль/л ½ ê - ½ - равновесие [PO43-] = с0 – сгидр. =½ ê [HPO42-] = h1 с0 ½ [OH–] = h1 с0 = с0 (1 – h1)
Гидролизующийся ион PO43– образовался по третьей ступени диссоциации фосфорной кислоты, поэтому Кг1 = откуда h1 = Заметим, что использование упрощенной формулы (1 << h1) возможно, если константа гидролиза Кг < 10–3, концентрация иона с0 > 0,001 моль/л; в противном случае следует проводить вычисления по общей формуле. Расчет рН в растворах кислых солей более сложен, поскольку анион может участвовать в двух конкурирующих процессах – гидролиза и диссоциации. Тем не менее, можно легко определить характер раствора, сравнивая константы равновесия этих процессов, и преобладает тот из них, у которого константа больше. Пример – в растворе гидрофосфата натрия Na2HPO4 → 2 Na+ + HPO42–, причем ион HPO42– может далее а) диссоциировать по III ступени HPO42– ↔ PO43– + Н+; К3(Н3РО4) = 1,26·10–12 б) гидролизоваться HPO42– + H2O ↔ H2PO4– + OH– Кг = Кw / К2(Н3РО4) = = 10–14 / 6,34·10–8 = 1,57·10–7. Видно, что преобладает процесс гидролиза HPO42– и раствор данной соли слабощелочной. ОБУЧАЮЩИЕ ЗАДАЧИ 1. Вычислить константу гидролиза Кг, степень гидролиза h и рН раствора хлорида аммония с концентрацией соли с(NH4Cl)=0,01 моль/дм3. Решение: 1) соль NH4Cl образована сильной кислотой HCl и слабым основанием NH4OH – гидролиз по катиону; гидролиз соли – процесс обратимый. NH4Cl + H2O = NH4OH + HCl NH4+ + H2O Û NH4OH + H+ - в результате гидролиза образуются ионы Н+, т.е. среда в растворе кислая. 2) константу гидролиза Кг рассчитывают по формуле:
где Кw – ионное произведение воды, Кw =10-14 (25 0С); Кb (NH4OH) – константа ионизации основания (справочная величина), Кb (NH4OH)=1,74·10-5.
3) степень гидролиза h соли рассчитывают по формуле:
где c о – молярная концентрация соли в растворе.
4) концентрация Н+ ионов равна концентрации гидролизованной части соли и ее определяют по формуле:
5) Ответ: константа гидролиза соли NH4Cl равна 5,75·10-10; степень гидролиза составила 2,4·10-4; рН раствора равен 5,62.
2. Определить константу гидролиза, степень гидролиза и рН раствора ацетата калия, если концентрация с (СН3СООК)=0,1моль/дм3, а Ка (СН3СООН)=1,8·10-5. Решение: 1) соль CH3COOK образована слабой кислотой CH3COOH и сильным основанием KOH – гидролиз по аниону, среда в результате гидролиза щелочная: CH3COOK + H2O = CH3COOH + KOH; СH3COO- + H2O Û CH3COOH + OH- – накапливаются ионы ОН-, среда щелочная. 2) константу гидролиза Кг рассчитывают по формуле:
где Ка – константа ионизации кислоты. 2) степень гидролиза h соли рассчитывают по уравнению:
где с0 – концентрация соли в растворе.
3) концентрация ОН- - ионов равна концентрации гидролизованной части соли:
4)
Ответ: константа гидролиза соли CH3COOK равна 5,6·10-10; степень гидролиза составила 7,5·10-5; рН раствора 8,88.
3. В результате реакции гидролиза гидрокарбоната натрия в его растворе создается слабощелочная среда. Рассчитайте рН раствора, содержащего 10 г гидрокарбоната натрия в 200 см3 раствора, если степень гидролиза равна 0,01 %. Решение: 1) соль NaHCO3 – кислая соль слабой угольной кислоты и сильного основания – гидролиз по аниону: NaHCO3 + H2O = NaOH + H2O + CO2 HCO3- + H2O Û OH- + H2O + CO2 – среда щелочная 2) концентрация ОН- - ионов равна концентрации гидролизованной части соли:
тогда 3)
Ответ: рН = 9,78. 6. Тема 4. Теория кислот и оснований Аррениуса и Бренстеда-Лоури. Сопряженные кислотно-основные пары. Буферные системы
Теоретические аспекты Буферные растворы – это растворы, способные сохранять заданное значение рН при разбавлении или добавлении к ним небольших количеств сильной кислоты или щёлочи. Последнее свойство называется буферным действием, и оно связано со строго определённым химическим составом растворов – буферные растворы содержат два находящихся в равновесии друг с другом компонента – кислоту и сопряженное основание, которые образуют сопряжённую кислотно-основную пару. Первый из них связывает в малодиссоциирующее соединение вносимые в раствор ионы ОН-, выполняя роль кислоты, а второй – связывает вносимые в раствор ионы Н+, выполняя роль основания. В данном случае понятия кислоты и основания соответствуют протолитической теории Н. Бренстеда и Т. Лоури (1923): кислота – вещество, являющееся донором протонов Н+ или акцептором ионов ОН- (ТЭД Аррениуса: кислоты –вещества, при диссоциации молекул которых образуются только катионы Н+); основание – вещество, являющееся акцептором протонов Н+ (ТЭД Аррениуса: основания – вещества, при диссоциации молекул которых образуются анионы только ОН-) Кислота, отдавая Н+, образует сопряженное основание. Вместе они – сопряженная кислотно-основная пара. Примеры:
По химическому составу буферные растворы делят на кислотные и основные: 1) кислотные буферные растворы – роль кислоты (к) выполняет слабая кислота или её кислая соль, а сопряжённым основанием (осн) является средняя соль этой кислоты или её кислая соль с большей степенью замещения ионов водорода на ион металла. Примеры: а) Уксусная кислота и её соль образует ацетатный буфер: СН3СООН (к) СН3СООNa (осн) б) Фосфорная кислота и её соли могут образовывать три типа буферных систем: в) Угольная кислота и её соли могут образовывать два типа буферных систем: 2) основные буферные растворы – роль основания (осн) выполняет слабое основание, роль кислоты (к) – соль этого слабого основания.
NH4Cl (к) буфер При записи состава буферного раствора рекомендовано первым указывать состав основания буферной смеси, затем, через запятую, кислоту. Называют буферный раствор по названию частицы, выполняющей роль основания.
|
||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-27; просмотров: 5052; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.216.174.32 (0.007 с.) |

 ,
, , [OH–] = h1 С0 =
, [OH–] = h1 С0 =  и pOH = - lg [OH–]= =(
и pOH = - lg [OH–]= =( ,
,
 ,
,


 ,
,
 ,
,



 , где h – степень гидролиза соли, а с(NaHCO3) – молярная концентрация соли в растворе:
, где h – степень гидролиза соли, а с(NaHCO3) – молярная концентрация соли в растворе: ,
,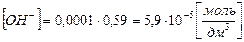




 Пример: NH4OH (осн) Аммиачный
Пример: NH4OH (осн) Аммиачный


