
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Титрование перманганатом (перманганатометрия)Содержание книги
Поиск на нашем сайте
Перманганат-ион MnO4- в сильнокислых растворах окисляет многие вещества, восстанавливаясь при этом до иона двухвалентного марганца: MnO-4 + 8Н+ + 5е = Mn2+ + 4Н2О В связи с высоким значением восстановительного потенциала (φ0 = 1,551 В) его можно применять для титрования почти всех веществ, способных окисляться. Основным условием титрования перманганатом является высокая кислотность среды; количество кислоты, необходимое для определения, нельзя рассчитывать по уравнению реакции. Необходимо, чтобы раствор был приблизительно 1н. по кислоте, иначе в конце титрования, вследствие расхода кислоты на реакцию, концентрация водородных ионов сильно уменьшается, что приводит к понижению потенциала, а также к протеканию побочного процесса выделения осадка MnO2. Чаще всего для подкисления применяют серную кислоту. Соляная кислота менее пригодна для этой цели, т.к. при этом возможно окисление ионов хлора перманганатом или различными промежуточными оксидами. Азотная кислота сама является сильным окислителем и может вызвать побочные процессы. При титровании перманганатом обычно не применяют индикатор, т.к. собственная окраска раствора реагента достаточно интенсивна. Точку конца титрования устанавливают по появлению окраски при добавлении одной избыточной капли титранта к аликвоте исследуемого раствора.
Особенности реактива Марганцевокислый калий не обладает абсолютно свойствами исходного вещества, соль часто содержит незначительные количества различных примесей, главной из которых является MnO2. Концентрация растворов KMnO4 некоторое время после приготовления медленно изменяется вследствие ряда причин. Вследствие этого раствор KMnO4 точно заданной концентрации не готовят непосредственно по точной навеске вещества. Нормальную концентрацию устанавливают по какому-либо другому веществу – вторичному стандарту. Хранят растворы KMnO4 в темной стеклянной посуде, защищенной от попадания пыли.
Определение пероксида водорода Качество препарата пероксида водорода определяется массовой долей Н2О2. Со временем пероксид водорода частично разлагается с выделением кислорода: Н2О2 → Н2О + Этот процесс особенно заметен, если хранить пероксид водорода на свету, а не в защищенном от света месте. Для проверки качества реактива определяют ω (Н2О2) в препарате. Сущность метода Пероксид водорода Н2О2 обладает одновременно свойствами окислителя и восстановителя, т.к. степень окисления атома кислорода в Н2О2 является промежуточной между степенью его окисления в Н2О и О2. Когда Н2О2 является окислителем, то его восстановление характеризуется полуреакцией: Н2О2 + 2е + 2Н+ = 2Н2О Действуя в качестве восстановителя, Н2О2 окисляется с выделением кислорода: Н2О2 – 2е → О2 + 2Н+ Перманганатометрическое определение пероксида водорода состоит в окислении его до свободного кислорода: 2MnO4- + 5H2O2 + 6H+ = 2Mn2+ + 5O2 + 8H2O или: 2КМnО4 + 5Н2О2 + 3Н2SO4 = 2МnSO4 + 5O2 + 8Н2О В точке эквивалентности:
Порядок выполнения работы. 1. В мерной колбе вместимостью 100 см3 получают задачу у преподавателя, (раствор пероксида водорода), разбавляют водой до метки на мерной колбе, тщательно перемешивают. Записывают в тетрадь объем мерной колбы (V м.к.). Плотность раствора 2. Предварительно вымытую и промытую стандартным раствором перманганата калия бюретку со стеклянным наконечником заполняют раствором титранта КMnО4, устраняют из носика пузырьки воздуха, доводят до нулевой метки. Записывают в тетрадь молярную концентрацию эквивалента стандартного раствора – раствора титранта. 3. Предварительно вымытой и промытой исследуемым раствором пипеткой отбирают аликвотную часть анализируемого раствора пероксида водорода, переносят раствор в тщательно промытую водой коническую колбу для титрования, приливают к раствору 10 – 15 см3 H2SO4 (1:4) и содержимое колбы титруют рабочим раствором KMnO4 до появления устойчивого розового окрашивания от одной избыточной капли добавленного раствора перманганата калия. Титрование повторяют три раза.
Примечание Первые капли раствора KMnO4 обесцвечиваются очень медленно, при интенсивном перемешивании, а затем по мере увеличения концентрации Mn2+ (катализатор) реакция идет значительно быстрее. Полученные результаты заносят в таблицу 1. Таблица 1 – Перманганатометрическое определение пероксида водорода (в растворе). (V м.к. = 200 см3, V ал = 10,0 см3; с (1/5 KMnO4) = 0,1 н; H2SO4 (1:4) – 10 – 15 см3)
Все расчеты выполняют в рабочей тетради, полученные результаты оформляют в виде отчета по проделанной работе.
Задание для домашней подготовки к занятию: I. Теоретические вопросы: 1. Приведите определение понятия степень окисления и укажите правила ее вычисления. Какие реакции называются окислительно-восстановительными (ОВ)? Что такое окисление, восстановление, окислитель, восстановитель? Как классифицируют окислительно-восстановительные реакции? 2. Перечислите типичные окислители и восстановители. 3. Какие методы составления уравнений окислительно-восстановительных реакций (расстановки коэффициентов) вам известны? 4. Что называют сопряженной ОВ парой? 5. Что является характеристикой ОВ свойств пары? 6. Какие ОВ-потенциалы называют стандартными? 7. Что такое - ЭДС окислительно-восстановительной реакции? Как рассчитать ЭДС окислительно-восстановительной реакции? 8. От каких факторов зависит ОВ потенциал? Приведите уравнение Нернста. 9. Какие ОВ потенциалы называют электродными потенциалами? 10. Что такое гальванический элемент? 11. Как измеряют значения восстановительных потенциалов? 12. Какой электрод используют в качестве эталона при измерении восстановительных потенциалов? 13. Каким образом, исходя из табличных значений восстановительных потенциалов, оценить возможность или невозможность самопроизвольного протекания ОВ-реакций? 14. Что такое, диффузионный и мембранный потенциалы и каково их биологическое значение? 15. Охарактеризуйте роль ОВ-реакций в процессах обмена вещества и энергии, происходящих в живых организмах. 16. Перечислите оксидиметрические методы анализа, применяемые в практике клинических, и санитарно-гигиенических исследований и укажите ОВ-реакции, на которых они основаны. II. Решите задачи и упражнения: 1. Определите степени окисления элементов в соединениях: H2SO4, K2SO3, Н2, KMnO4, Н2О2, NH3, K2MnO4, K2Cr2O7, H2S, PbO2; найдите среди них типичные окислители, восстановители, соединения с ОВ-двойственностью. 2. Выделите в реакции Zn + S → ZnS сопряженные ОВ-пары, найдите для них значения стандартных восстановительных потенциалов, рассчитайте величину ЭДС реакции образования сульфида цинка, и определите направление ее самопроизвольного протекания. 3. Выберите наиболее сильные окислитель и восстановитель среди сопряженных ОВ-пар: Fe3+/Fe2+, Сl2/2Сl-, J2/2J-; для всех пар выпишите табличные значения стандартных восстановительных потенциалов. Установите направление самопроизвольного протекания реакций (в стандартных условиях) в системах, образованных каждыми двумя из указанных ОВ-пар. 4. Укажите окислитель, восстановитель, запишите процессы окисления, восстановления и расставьте коэффициенты в схемах реакций: H2S + K2Cr2O7 + H2SO4 → S + Cr2(SO4)3 + K2SO4 + Н2О Н3РО4 + HJ → Н3РО3 + J2 + Н2О КNО2 + SnCI2 + Н2О → HCI + Sn + HNO3 Задачи для самостоятельного решения 1. Сколько граммов перманганата калия потребуется для приготовления 500 см3 раствора с молярной концентрацией эквивалента KMnO4 0,1 моль/дм3? 2. На титрование 0,2343 г сульфита натрия в присутствии серной кислоты израсходовано 34,5 см3 раствора KMnO4. Определить молярную концентрацию эквивалента перманганата калия в растворе. 3. К 189 мг сульфита натрия добавлено 12 см3 водного раствора йода. Непрореагировавшее количество йода оттитровали 5 см3 раствора тиосульфата натрия с молярной концентрацией эквивалента Na2S2O3 0,6 моль/дм3. Рассчитать молярную концентрацию эквивалента йода в растворе. 4. Навеска оксалата натрия растворена в мерной колбе вместимостью 500 см3. На титрование 20 см3 полученного раствора расходуется 21,4 см3 раствора KMnO4, титр которого равен 0,0057 г/см3. Сколько граммов оксалата натрия в навеске образца? 5. К 25 см3 водного раствора перманганата калия с молярной концентрацией эквивалента KMnO4 0,05 моль /дм3 добавили раствор нитрита калия в серной кислоте, избыток перманганата калия оттитровали 5 см3 раствора щавелевой кислоты с молярной концентрацией эквивалента H2C2O4 0,04 моль/дм3. Рассчитать массу нитрита калия в исходном растворе.
|
|||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-27; просмотров: 348; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.226.98.244 (0.008 с.) |

 О2
О2
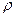 считать равной 1 г/см3.
считать равной 1 г/см3. (H2O2), %
в задаче
(H2O2), %
в задаче



