
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Влияние одноименного иона на растворимость малорастворимого электролитаСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Повышение концентрации ионов Аz+ или Вz- сверх равновесной должно привести к нарушению динамического равновесия в направлении осаждения новых порций осадка. Это означает, что при внесении в насыщенный раствор малорастворимого электролита другого сильного электролита, молекулы которого содержат одноименный с осадком ион (Аz+ или Вz-), растворимость малорастворимого электролита уменьшается, раствор становится пересыщенным. В данном случае молярная растворимость S [моль/дм3] осадка малорастворимого электролита определяется концентрацией другого иона малорастворимого соединения в насыщенном над осадком растворе, который одноименным не является. Примеры: 1) Обозначим растворимость Са3(PO4)2 в присутствии хлорида кальция через S* (очевидно S* << S) и рассчитаем равновесные концентрации ионов Ca2+ и PO43- над осадком:
Таким образом, в растворе над осадком источниками ионов кальция является две соли и [Ca2+ ] = [Ca2+]* + 0,1» 0,1 моль/дм3, так как [Ca2+]* << 0,1 моль/дм3, источником фосфат – ионов является только фосфат кальция и [PO43-] = [PO43-]* = 2S* . Величина произведения растворимости фосфата кальция не зависит от состава раствора над осадком и сохраняет свое численное значение: ПР(Са3(PO4)2) = [Ca2+]3∙[PO43-]2 = (0,1)3× (2S*)2 = 4×10-3 × S*2, откуда S* =
2) Обозначим растворимость Са3(PO4)2 в присутствии фосфата натрия через S* (очевидно S* << S) и рассчитаем равновесные концентрации ионов Ca2+ и PO43- над осадком:
Таким образом, в растворе над осадком источниками фосфат – ионов являются две соли, и [PO43-] = [PO43-]* + 0,1» 0,1 моль/дм3, так как [PO43-]* << 0,1 моль/дм3; источником ионов кальция является только фосфат кальция и [Ca2+] = [Ca2+]* = 3S*. Величина произведения растворимости фосфата кальция не зависит от состава раствора над осадком и сохраняет свое численное значение:
ПР(Са3(PO4)2) = [Ca2+]3× [PO43-]2 = (3S*)3 × 0,12 = 0,27×S*3, откуда
S* =
Выбор осадителя для отделения того или иного иона – осадитель подбирают таким образом, чтобы ПР осаждаемого соединения было наименьшим (т.е. осаждаемое вещество имело наименьшую растворимость). Последовательность осаждения ионов: если к раствору, содержащему смесь ионов, осаждаемых одним и тем же осадителем, добавлять этот осадитель, то первым будет осаждаться тот электролит, для достижения ПР которого требуется наименьшая концентрация иона-осадителя. Пример: если к раствору, содержащему смесь CI-, Br-, I-добавить ион-осадитель Ag+, то последовательность выпадения осадков будет следующая: 1 – AgI (ПР (AgI) =8,3.10-17), 2 – AgBr (ПР (AgBr) = 5,0.10-13), 3 – AgCI (ПР(AgCI) = 1,8.10-10). Достижение полноты осаждения ионов часто требуется при выполнении практических задач. Для этого используют избыток иона-осадителя(см. влияние одноименного иона на растворимость осадка).
ОБУЧАЮЩИЕ ЗАДАЧИ 1. Выпадает ли осадок при смешении равных объемов 10-4 М растворов Pb(NO)2 и Na2SO4? ПРPbSO4= 1,6∙10-8. Решение. В насыщенном растворе сульфата свинца устанавливается равновесие: PbSO4 Û Pb2+ + SO42- При смешении равных объемов указанных растворов солей концентрация каждого из них уменьшается вдвое и становится равной 5∙10-5 моль/дм3. В растворе концентрация ионов свинца равна концентрации сульфат-ионов: [Pb2+]=[SO42-] = 5∙10-5 моль/дм3. Ионное произведение ПИ: ПИ = [Pb2+]∙[SO42-] = 2,5∙10-9. Из расчета следует, что ПИ < ПР, т.е., раствор ненасыщенный, осадок не выпадает.
2. Растворимость AgSCN в воде составляет 1,035∙10-6 моль/дм3 при 250С. Вычислить ПРAgSCN при данных условиях. Решение. В насыщенном растворе устанавливается следующее равновесие: AgSCN Û Ag+ + SCN-, которое показывает, сколько молекул растворилось, перешло из осадка в раствор, сколько ионов каждого сорта образовалось. Если S (моль/дм3) – растворимость осадка, то концентрация молекул, перешедших в раствор, равна концентрации каждого из ионов:
ПР AgSCN = [Ag+]∙[ SCN-] = S2 = (1,035∙10-6)2 = 1,07∙10-12.
3. Вычислить растворимость в (г/дм3) соли Ca5(PO4)3OH (М = 502 г/моль), если известно, что ПРCa5(PO4)3OH = 1,6∙10-58.
Решение. В насыщенном водном растворе малорастворимый гидроксиапатит диссоциирует следующим образом: Ca5 (PO4)3OH Û 5 Са2+ + 3 РО43- + ОН- Рассуждая аналогичным образом:
ПР = (5S)5 · (3S)3 · S = 84375S9
S =
4. Вычислить, как изменится растворимость ВаСrО4 в 2,0·10-3 М растворе Na2CrO4 по сравнению с растворимостью в чистой воде, если ПР ВаСrО4= 1,2·10-10. Решение. Растворимость ВаСrО4 в воде (S1) равна, согласно равновесию в насыщенном растворе: ВаСrО4 Û Ва2+ + СrО42-
В растворе Na2CrO4 (S2):
Лабораторная работа № 4
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-27; просмотров: 1123; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.217.128.191 (0.011 с.) |

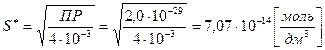 << S = 7,13 ×10–7
<< S = 7,13 ×10–7 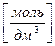 .
.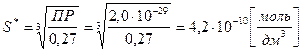 << S = 7,13 ×10–7
<< S = 7,13 ×10–7  =
=  = 1,074∙10-7∙502 = 5,39∙10-5 [ г/дм3 ].
= 1,074∙10-7∙502 = 5,39∙10-5 [ г/дм3 ].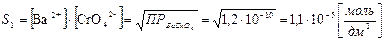

 – растворимость уменьшится в 183 раза.
– растворимость уменьшится в 183 раза.


