
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Влияние состава раствора на растворимостьСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Рассмотрим растворимость AgCl: В чистой воде γ± можно принять равным единице, так как концентрация ионов мала; n = m =1: SP =11∙11∙ S 2∙11/2, В растворе, содержащем одноименные с солью хлорид анионы Cl−, например, из KCl, растворимость определяется концентрацией ионов серебра, а γ± отличен от 1 за счет сильного электролита KCl: SP =[Ag+]∙[Cl−]∙ В растворе, содержащем посторонние ионы, например, из KNO3, растворимость отождествляется с концентрацией ионов Ag+ или Cl−, а γ± отличен от 1 за счет сильного электролита KNO3: SP =[Ag+]∙[Cl−]∙ Расчеты показывают, что растворимость малорастворимого соединения незначительно повышается при введении постороннего электролита и резко (на несколько порядков) уменьшается при введении электролита, имеющего одноименные ионы. Это используется на практике для достижения полноты осаждения отделяемых ионов при систематическом анализе, когда берут некоторый избыток реагента, например, HCl при осаждении катионов первой аналитической группы в виде хлоридов, H2SO4 при осаждении катионов второй группы в виде сульфатов и т.д. Превращение одних малорастворимых электролитов в другие В практике качественного анализа часто приходится превращать одни осадки в другие. Сущность происходящего можно объяснить, используя понятие «произведение растворимости» (SP). Если к системе, состоящей из насыщенного раствора Ag2CrO4 и кирпично-красного осадка Ag2CrO4 прилить избыток раствора KCl и содержимое встряхнуть, то наблюдается изменение цвета осадка за счет образования белого творожистого AgCl: Ag2CrO4 + 2Cl– → 2AgCl↓ + CrO42–. кирпично-красный, тв. белый, тв. Это происходит потому, что растворимость хлорида много меньше растворимости хромата SAgCl << S - SPAgCl = 1,73ּ10-10 (моль/л)2 = [Ag+]ּ[Cl–], откуда [Ag+] = SAgCl = - SP Аналогично нерастворимые ни в кислотах, ни в щелочах сульфаты Ва, Sr и Ca переводят в карбонаты, легко растворимые даже в уксусной кислоте: СaSO4 + Na2CO3 твердый конц. р-р Реакция идет практически до конца, так как SP Следует отметить, что обратный переход превращения менее растворимых в более растворимые затруднен, а при большой разнице в SP (~ 106) вообще не идет, например, переход AgI → AgCl (SAgI = 8,1ּ10-17, SAgCl = 1,73ּ10-10).
Вопросы 1. Чем химические методы анализа отличаются от инструментальных? 2. В чем заключается условность понятия «степень окисления» атома элемента? 3. Какие аналитические реакции называются «сухими»? 4. На чем основано отнесение иона к той или иной аналитической группе? 5. Какие ионы открывают дробным анализом и при систематическом ходе анализа? 6. В каком виде отделяют амфотерные катионы при кислотно-щелочной системе? 7. Общие и отличительные реакции галогенид-анионов. 8. Сформулировать закон действующих масс. 9. Чем химическое равновесие отличается от механического? 10. Способы изменения равновесного состояния. 11. Какие проводники относят к электролитам? 12. Как степень ионизации молекул вещества зависит от его концентрации? 13. Связь общей константы ионизации многоосновной кислоты с константами отдельных ступеней. 14. Как подавить гидролиз соли слабого основания? 15. Расчет рН раствора соли, подвергающейся гидролизу. 16. Основные положения протолитической теории кислот и оснований. 17. Какие смеси обладают буферирующим свойством? 18. Анализ уравнения Henderson-Hasselbalсh. 19. Суть буферирующего действия на примере системы НСООН+НСООNa. 20. Связь растворимости малорастворимого соединения и его произведения растворимостей. 21. Как нерастворимый в кислотах ВаSО4 перевести в раствор?
Практические задания 1. Вычислить объем V соляной кислоты (плотность d=1,19 г/см3), который нужно взять для приготовления 500,0 мл 0,5000 N раствора. а) V HCl=7,67 мл; б) V HCl=9,25 мл. 2. Растворимость S сульфата кальция CaSO4 равна 1 г/дм3. Этот насыщенный раствор смешивают с равным объемом оксалата аммония (NH4)2C2O4, содержащего 0,0248 г соли в 1 л. Вычислить ионное произведение I концентраций оксалата кальция в момент сливания растворов и решить, образуется ли осадок CaC2O4. Произведение растворимости SPCaC а) не образуется, т.к. IPCaC б) образуется, т.к. IPCaC 3. Вычислить [H+] и pH 0,05 N раствора муравьиной кислоты. Ki HCOOH= 1,772∙10–4. а) [H+]=2,98∙10–3 моль/л; pН=2,53; б) [H+]=2,51∙10–3 моль/л; pН= 2,60. 4. Как изменится pH раствора при добавлении 10,0 мл 1,0 N раствора соляной кислоты к 1 л ацетатной буферной смеси, состоящей из 0,10 N уксусной кислоты и 1,0 N ацетата натрия. Ki CH а) ΔpH=0,05; б) ΔpH=0,07.
Примеры решения задач 1. Вычислить рН 0,25%-ного раствора аммиака. Ki(NH3·Н2О) = 1,74·10 –5. Решение: Раствор аммиака в воде является слабым основанием, ионизирующим по уравнению: NH3 ·H2O Ki= Пусть объем раствора Vр-ра =1 л, его плотность d=1 г/мл. Тогда в 1 л раствора содержится:
СNH [OH–] = рОН = – lg[OH–] = –lg(1,60·10–3)=2,80. рН =14,0–рОН = 14,0–2,80=11,2. Ответ: рН р-ра NH3 = 11,2. 2. Вычислить произведение растворимости SP Fe(OH)3, если растворимость его в воде S Fe(OH) Решение: Гидроксид железа (III) ионизирует по уравнению: Fe(OH)3↔Fe3++3OH– Выражение произведения растворимости для него: SP Fe(OH) Можно показать, что растворимость S и произведение растворимости SP связаны выражением SP=(nn·mm)·S(n+m), где n, m ‑ число катионов и анионов соответственно: SP=(11·33)·S(1+3)=27S4. В приведенных формулах концентрации должны быть в молях на литр, поэтому: S=2·10–8г/л= SP=27·(1,87·10–10)4=3,30·10–38 (моль/л)4. Ответ: SPFe(OH) Литература 1. Основы аналитической химии. Практическое руководство (под ред. Ю.А. Золотова). М.: Высшая школа, 2006, 460 с. 2. Коренман Я.И. Практикум по аналитической химии. М.: Колос, 2005, 237с. 3. Коренман Я.И., Суханов П.Т. Задачник по аналитической химии. Воронеж: ВГТА, 2004, 339 с. 4. Цитович И.Е. Курс аналитической химии. - М.: Высшая школа, 1994, 495 с. 5. Васильев В.П. Аналитическая химия. - М.: высшая школа, 1989, Т. 1, 384 с. 6. Логинов Н.Я., Воскресенский А.Г., Солодкин И.С. Аналитическая химия. - М.: Просвещение, 1979,479 с. 7. Крешков А.П. Основы аналитической химии. - М.: Химия, 1970, 471 с. 8. Бончев П.Р. Введение в аналитическую химию. - Л.: Химия, 1978,496 с.
Глава 3. Количественный химический анализ Количественный анализ – совокупность методов (теоретических и практических) определения абсолютного или относительного содержания химических элементов в веществах и (или) веществ в смесях. Оптические методы. Основаны на исследовании спектров поглощения, излучения и рассеяния веществ. 1. Фотометрический – изучение поглощения окрашенными веществами в видимой и УФ областях. 2. Нефелометрический – измерение рассеяния света коллоидными системами. 3. Эмиссионный спектральный – изучение спектров излучения (эмиссии) возбужденных атомов. 4. Фотометрия пламени – измерение интенсивности излучения при возбуждении пламенем с помощью фотоэлементов; чувствительность 10-3 г. 5. Л юминесцентный – измерение люминесценции (свечения) при возбуждении УФ. Интенсивность свечения ~ концентрации. Чувствительность 10-8÷-10 г. 6. Рентгеноспектральный – исследование вещества с помощью рентгеновских (Х) лучей по: - характеристическому рентгеновскому излучению; - анализу энергии испускаемых электронов – электронная спектроскопия.
Таблица 6 Методы количественного анализа
Электрохимические методы: 1. Электрогравиметрический. Электролиз с выделением веществ на электродах и их взвешивание (метод внутреннего электролиза здесь же). 2. Электротитриметрический (объемный). Эквивалентную точку определяют по изменению некоторых электрических свойств раствора. 3. Потенциометрический. Измеряют потенциал электрода. 4. Кондуктометрический. Измеряют электропроводимость системы. 5. Кулонометрический. Определяют количество электричества, идущего на окисление или восстановление вещества. 6. Вольтамперометрический. Изучают зависимость ток ‑ потенциал. Полярографический. Определяют величину диффузионного тока, пропорциональную концентрации вещества. Масс-спектральный метод. Основан на разделении потока ионов в электрическом и магнитном поле в зависимости от отношения их массы к заряду. Чувствительность до 10–15 г. Хроматографический метод. Основан на разделении смеси растворенных веществ, смеси газов, паров жидкостей сорбционным методом в динамических условиях. Существует жидкостная (колоночная, бумажная, тонкослойная), газо-жидкостная, газовая хроматография. Радиометрический метод. Основан на измерении счетчиками Гейгера-Мюллера интенсивности излучения в единицу времени радиоактивных элементов, входящих в вещество. Чувствительность до 10–11 г. Гравиметрический анализ
|
|||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 570; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.147.48.226 (0.01 с.) |

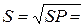 [Ag+] = [Cl−].
[Ag+] = [Cl−].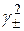 = S ∙[Cl−]∙
= S ∙[Cl−]∙ 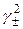 .
. 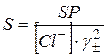 .
.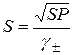 .
.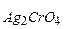 . В насыщенном растворе Ag2CrO4 концентрация Ag+ достаточна, чтобы превысить SPAgCl. Образование осадка AgCl уменьшает [Ag+] в растворе, и он становится ненасыщенным относительно Ag2CrO4, что приводит к его растворению. При избытке KCl весь осадок хромата серебра можно перевести в хлорид серебра. Сказанное подтвердим расчетом [Ag+] в насыщенном растворе AgCl и Ag2CrO4:
. В насыщенном растворе Ag2CrO4 концентрация Ag+ достаточна, чтобы превысить SPAgCl. Образование осадка AgCl уменьшает [Ag+] в растворе, и он становится ненасыщенным относительно Ag2CrO4, что приводит к его растворению. При избытке KCl весь осадок хромата серебра можно перевести в хлорид серебра. Сказанное подтвердим расчетом [Ag+] в насыщенном растворе AgCl и Ag2CrO4: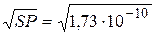 = 1,32ּ10-5моль/л;
= 1,32ּ10-5моль/л;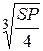 =
= 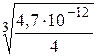 = 1,055 . 10-4 моль/л. [Ag+] = 2S = 2,11ּ10-4 моль/л.
= 1,055 . 10-4 моль/л. [Ag+] = 2S = 2,11ּ10-4 моль/л. CaCO3↓ + Na2SO4.
CaCO3↓ + Na2SO4.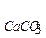 << SP
<< SP 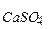 (3,7ּ10-9 << 1,7ּ10-5).
(3,7ּ10-9 << 1,7ּ10-5).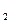 O
O  = 2,3∙10–9 (моль/л)2.
= 2,3∙10–9 (моль/л)2.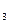 COOH=1,754∙10–5?
COOH=1,754∙10–5?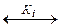 NH4++OH–
NH4++OH–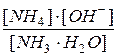 , откуда [OH–]=[NH4+] =
, откуда [OH–]=[NH4+] = 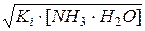 .
.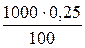 =2,5 г NH3, откуда
=2,5 г NH3, откуда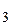 =[NH3·H2O]=
=[NH3·H2O]= 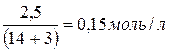 .
.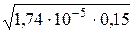 =1,60·10–3 моль/л.
=1,60·10–3 моль/л.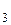 =[Fe3+]·[OH–]3.
=[Fe3+]·[OH–]3.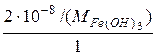 =
= 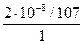 =1,87·10–10 моль/л,
=1,87·10–10 моль/л,


