
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Сущность гравиметрического анализаСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Гравиметрический анализ основан на определении массы вещества. В ходе гравиметрического анализа определяемое вещество или отгоняется в виде какого-либо летучего соединения (метод отгонки), или осаждается из раствора в виде малорастворимого соединения (метод осаждения). Метод отгонки определяет, например, содержание кристаллизационной воды в кристаллогидратах, если вещество при нагревании не претерпевает других химических изменений, кроме выделения воды: BaCl2×2H2O (кр) = BaCl2 (кр) + 2H2O (г) Для определения содержания SiO2 часто используют реакцию с фтороводородной (плавиковой) кислотой, в результате которой образуется летучий SiF4: SiO2+4НF = SiF4 +2H2O Метод отгонки применяют также при анализе карбонатов, некоторых нитратов и других соединений, образующих летучие продукты реакции. Содержание анализируемого компонента определяют по изменению массы вещества в результате термической обработки (обычно, уменьшению) или по увеличению массы поглотителя газообразных продуктов реакции. Методы осаждения применяются более широко и их практическое значение намного больше, чем методов отгонки. Соединение, в виде которого определяемый компонент осаждается из раствора, называется формой осаждения. Например, при осаждении сульфата формой осаждения является BaSO4, при осаждении железа (III) – соответствующий гидроксид Fe(OH)3. После фильтрования и промывания осадок высушивают или прокаливают до постоянной массы и взвешивают. Соединение, в виде которого производят взвешивание, называют гравиметрической формой. При высушивании и прокаливании осадков могут происходить химические процессы, например: 2Fe(OH)3 СаС2О4 СаCO3 Гравиметрическая форма по составу может отличаться от формы осаждения. Нередко, форма осаждения и гравиметрическая форма совпадают, как это видно на примере BaSO4. Форма осаждения К форме осаждения предъявляются следующие основные требования: - осадок должен быть малорастворим, т.е. осаждение должно быть достаточно полным; - полученный осадок должен бить чистым и легко фильтрующимся. Необходимо также, чтобы из формы осаждения легко получалась гравиметрическая форма. Решающее влияние на полноту осаждения и свойства осадков оказывают следующие условия: - концентрация (количество) осадителя; - температура; - концентрация посторонних солей. Полнота осаждения Путь, например, SO SPBaSO4 = [Ва2+] [SO Требование полноты осаждения сульфата вовсе не означает, что концентрация сульфат-иона в растворе после осаждения должна быть равна нулю, так как ПР – величина конечная. 1,0·10-6 моль/л ‑ это означает часто принимают как количественный критерий полноты осаждение. Найдем, при какой концентрации ионов Ba2+ сульфат будет полностью осажден из раствора, если условием полноты осаждения считать [SO4-2] ≤ 1·10-6 моль/л. Подставляем это значение в выражение произведения растворимости:
Коэффициенты активности для простоты расчета принимаем равными 1. ПР зависит от температуры. Эта зависимость выражается известным в химической термодинамике уравнением изобары реакции. Процесс растворения малорастворимой соли обычно эндотермичен, т.е. ∆Н > 0, и следовательно, Таким образом, для достижения полноты осаждения необходим избыток осадителя и нежелательны посторонние электролиты, вызывающие уменьшение коэффициентов активности и, как следствие, возрастание растворимости осадка. Однако чрезмерно большой избыток осадителя также нежелателен, так как это может привести к частичному растворению осадка за счет комплексообразования и солевого эффекта: кроме того, избыток осадителя увеличивает загрязнения осадка вследствие соосаждения. Чистота осадка Образование осадков является сложным физико-химическим процессом, закономерности протекания которого раскрыты не полностью. Образование незагрязненных крупнокристаллических осадков является необходимым условием получения точных результатов в гравиметрическом анализе. Крупнокристаллические осадки получаются более чистыми, чем мелкокристаллические или аморфные, так как имеют менее развитую поверхность и поэтому адсорбируют меньше примесей и, кроме того, крупнокристаллические осадки могут забивать поры фильтра и тогда скорость фильтрования падает практически до нуля. На размер кристаллов оказывают влияние относительные скорости двух основных процессов: скорость образования центров кристаллизации и скорость роста кристаллов. При небольшой скорости образования центров кристаллизации по сравнению со скоростью роста кристаллов в растворе будет происходить образование небольшого числа крупных кристаллов. Скорость образования центров кристаллизации, а следовательно, и их число зависят от величины относительного пересыщения (ОП) раствора, которое выражается:
где Q – концентрация осаждаемого компонента; S – его растворимость. Чем больше относительное пересыщение, тем больше скорость образования центров кристаллизации и тем мельче будут образующиеся кристаллы. Для уменьшения числа центров кристаллизации в растворе в соответствии с формулой, необходимо уменьшить Q и увеличить S. По этой причине перед осаждением многих веществ раствор рекомендуется разбавить для уменьшения Q и нагреть для увеличения S, а также ввести электролит, чаще всего соли аммония, для увеличения S или с этой же целью подкислить раствор. Еще более эффективным приемом равномерного введения небольших концентраций осадителя является осаждение из гомогенного раствора (гомогенное осаждение), или метод возникающих реактивов. В этом методе осадитель образуется в результате гидролиза специально введенного реагента в анализируемом растворе. Например, при осаждении оксалата кальция в кислый раствор, содержащий ионы Са2+ и щавелевую кислоту, вводят карбамид, который при нагревании медленно гидролизуется: (NH2)2CO + H2O = 2NH3 + CO2 Образующийся аммиак уменьшает кислотность раствора, что приводит к медленному увеличению концентрации С2О4- ионов и, как следствие, к осаждению крупнокристаллического осадка оксалата кальция. Сульфат-ион в растворе по этому методу получают при гидролизе диметил- или диэтилсульфата: (CH3)2SO4 + 2H2O = 2 CH3OH + HSO4- + H+, а фосфат – при гидролизе триметилфосфата. Основными причинами, вызывающими загрязнение осадков, являются процессы адсорбции и окклюзии. Чем мельче кристаллы осадка, тем больше их суммарная поверхность и тем больше число ионов будет на них адсорбировано. С этой точки зрения в гравиметрическом анализе более предпочтительными являются крупнокристаллические, а не аморфные осадки с сильно развитой поверхностью. При повышении температуры адсорбция уменьшается, что приводит к по лучению более чистых осадков. Для уменьшения загрязнения за счет соосаждения часто применяют настаивание; кристаллический осадок вместе с маточным раствором выдерживают более или менее длительное время, в течение которого в системе раствор – осадок протекают сложные физико-химические процессы, называемые старением осадка. Длительность старения или созревания различных осадков колеблется в очень широких пределах (от 0,5 до 10…20 ч), а нередко раствор с осадком рекомендуется оставить на ночь. В процессе старения происходит рекристаллизация первичных частиц, растворение мелких и рост крупных кристаллов, поскольку растворимость кристаллов с уменьшением их размера увеличивается, превращение осадка в устойчивую модификацию и т.д. При этом протекает также обменная адсорбция, сущность которой заключается в замене ионов, не удаляющихся при прокаливании осадка, на ионы удаляющиеся, большей частью на ионы аммония, соли которых при прокаливании образуют газообразные продукты разложения и таким образом не вносят погрешности при взвешивании осадка. Во многих аналитических прописях рекомендуется проводить осаждение в присутствии солей аммония. Одной из основных причин такой рекомендации является создание условий для обменной адсорбции, т.е. для замены адсорбированных ионов на ионы аммония. Наиболее радикальным средством борьбы с загрязнением осадка является переосаждение, или повторное осаждение. Для этого осадок фильтруют, промывают на фильтре, растворяют в кислоте и снова осаждают. Содержание примесей в полученном таким образом осадке резко снижается. Сопоставление условий, при которых достигается полнота осаждения и получается крупнокристаллический чистый осадок, показывает, что на первый взгляд они довольно противоречивы. Для достижения полноты осаждения нужна низкая температура (чтобы понизить ПР), а для получения чистых, легко фильтрующихся крупнокристаллических осадков необходимо вести осаждение из горячих растворов. Для полноты осаждения требуется избыток осадителя, а для получения чистых крупнокристаллических осадков следует ограничиваться минимальным количеством осадителя и т.д. Противоречия здесь чисто кажущиеся. Требования, относящиеся к образованию чистых крупнокристаллических осадков (горячие растворы, концентрация осадителя и т.д.), соблюдаются в начале осаждения, когда идет формирование кристаллов, а для обеспечения полноты осаждения в конце процесса следует добавить избыток осадителя. Конкретные рекомендации о количестве осадителя и других условиях осаждения обычно указываются в аналитических прописях. Промывание осадков Крупнокристаллические легко фильтрующиеся осадки промывают непосредственно на фильтре. Аморфные студенистые осадки обычно перед перенесением на фильтр промывают декантацией, сливая прозрачную жидкость над осадком через фильтр и снова взмучивая осадок промывной жидкостью и опять ее сливая. Промывание декантацией часто применяют при переосаждении. При этом первичный осадок совсем не переносят на фильтр, а после промывания декантацией растворяют и переосаждают, не забывая, разумеется, и ту небольшую массу осадка, которая могла оказаться на фильтре при промывании декантацией. Осадок на фильтре промывают небольшими порциями промывной жидкости, так как при одном и том же общем объеме промывных вод многократная промывка небольшими порциями является более эффективной, чем при меньшем числе раз большими порциями жидкости. В качестве промывной жидкости только в редких случаях применяют воду. Обычно берут раствор соли аммония, имеющей общий ион с осадком, разбавленный раствор аммиака или азотной кислоты или какого-либо другого электролита. Гравиметрическая форма На заключительной стадии анализа осадок (форму осаждения) после фильтрования и промывания высушивают или прокаливают и получают в результате такой термической обработки гравиметрическую форму – соединение, пригодное для взвешивания. Высушивание или прокаливание осадка продолжают до тех пор, пока его масса не станет постоянной, что обычно рассматривается как критерий достигнутой полноты превращения формы осаждения в гравиметрическую форму и указывает на полноту удаления летучих примесей – растворителя, адсорбированных солей аммония и т.д. Главное требование к гравиметрической форме: необходимость точного соответствия ее состава определенной химической формуле, так как только тогда по массе осадка можно рассчитать содержание анализируемого компонента в пробе. Гравиметрическая форма должна обладать также определенной химической устойчивостью в некотором достаточно широком интервале температур, оставаться устойчивой на воздухе при обычной температуре, то есть не быть гигроскопичной и не реагировать с другими компонентами окружающей атмосферы. Желательно, чтобы у гравиметрической формы была большая относительная молекулярная масса, и содержание определяемого элемента в ней было возможно меньшим. Расчеты в гравиметрическом анализе Если т - масса гравиметрической формы, например BaSO4, а в результате анализа требуется определить массу серы S, то результат можно рассчитать по простой пропорции. Обозначим молярную массу BaSO4, как М(BaSO4), молярную массу S как М(S). Составим пропорцию: из М(BaSO4) г BaSO4 получается М(S) г S «m(BaSO4) «««х «S. Решая эту пропорцию, получаем: х=m(BaSO4) Отношение молярной массы определяемого компонента к молярной массе гравиметрической формы называют фактором пересчета, или гравиметрическим фактором (множителем), или просто фактором и обозначают буквой F. Следовательно, х=mF. Титриметрический анализ Основан на определении объемов растворов (взаимодействующих веществ), концентрация одного из которых известна. По используемым реакциям различают: 1. Методы кислотно-основного титрования (нейтрализации) Определяют кислоты, щелочи, гидролизующиеся соли. Используются индикаторы, изменяющие окраску в зависимости от рН среды. 2. Методы окисления-восстановления (редоксиметрия) - перманганатометрия, рабочий раствор КМnО4 является окислителем; определяют Fe2+, NO2−, CNS−; - йодометрия, рабочий раствор I2 – окислитель, вспомогательный раствор KI – восстановитель; определяют KMnO4, MnO2, Cl2, Na2SO3 Cu2+; - хроматометрия, K2Cr2O7 – окислитель; - броматометрия, KВrO3 – окислитель; - ванадатометрия, рабочий раствор NH4VO3 – окислитель; - цериметрия, окислитель и рабочий раствор − соединия Се (IV). 3. Методы осаждения – определяемый элемент переходит в осадок. По применяемому рабочему раствору существует - аргентометрия (AgNO3); - роданометрия (NH4CNS); - меркурометрия (Hg22+). 4. Методы комплексообразования. Основаны на образовании комплексных ионов. Используются комплексоны (трилон Б). Способы титрования: 1) прямого титрования; 2) обратного титрования (избытка); 3) замещения. Исходные и рабочие титрованные растворы Титрованные растворы – растворы с точно известной концентрацией. Первичный стандартный (исходный) раствор готовят из веществ, которые должны удовлетворять ряду требований. В качестве веществ для исходных растворов обычно применяют буру Na2B4O7·10H2O, щавелевую кислоту H2C2O4·2H2O, оксалат натрия Na2C2O4, янтарную кислоту H2C4H4O4, KCl, NaCl, K2Cr2O7, Na2CO3 и т.д. В качестве вторичных стандартных растворов, которые называют также рабочими растворами или титрантами, применяют H2SO4 (стандартизируют по тетраборату натрия), КОН (стандартизируют по щавелевой кислоте), Na2S2O3 (стандартизируют по дихромату калия) и т.д.
Таким образом в титриметрии существует следующая последовательность определения характеристик растворов: первичный стандартный → вторичный стандартный (титрант) → исследуемый раствор.
|
|||||||||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 678; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.145.170.164 (0.008 с.) |

 Fe2O3 + 3Н2О
Fe2O3 + 3Н2О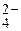 осаждается ионами Ba2+ в виде ВаSO4. Концентрация ионов SO
осаждается ионами Ba2+ в виде ВаSO4. Концентрация ионов SO 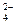 ] r2±
] r2± .
. , т.е. с ростом температуры ПР растет. Таким образом, с точки зрения полноты осаждения низкая температура является благоприятным условием. Влияние температуры на полноту осаждения оказывается практически несущественным, так как полнота осаждения достигается при всех температурах.
, т.е. с ростом температуры ПР растет. Таким образом, с точки зрения полноты осаждения низкая температура является благоприятным условием. Влияние температуры на полноту осаждения оказывается практически несущественным, так как полнота осаждения достигается при всех температурах.
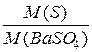 .
.


