Определение содержания NaCl в в растворе
Похожие статьи вашей тематики
(обратное титрование по Фольгарду)
Реагенты
Хлорид натрия NaCl, х.ч., 0,04 раствор (первичный стандартный раствор);
Роданид аммония NH4SCN, 0,04 раствор, титрант (вторичный стандартный раствор);
Нитрат серебра AgNO3, 0,05 н раствор (вторичный стандартный раствор);
Азотная кислота HNO3, 4 н.
Индикатор – железоаммонийные квасцы NH4Fe(SO4)2 · 12H2O
1. Приготовление первичного стандартного раствора хлорида натрия NaCl, 0,04 н
Стандартный раствор готовят из химически чистого хлорида натрия NaCl, грамм-эквивалент его равен молекулярной массе, т.е. 58,44.
Для приготовления 250 мл 0,04 н раствора NaCl следует взять навеску:

Рассчитанное количество хлорида натрия взвешивают в бюксе сначала на технических весах, а затем точно на аналитических весах, количественно переносят в мерную колбу, растворяют в холодной дистиллированной воде, добавляют воды до метки и тщательно перемешивают. Пустой бюкс взвешивают на аналитических весах; навеска апракт. определяется по разнице взвешиваний.
Нормальность приготовленного раствора хлорида натрия определяется по формуле:
N =  , г-экв/л , г-экв/л
2. Установление концентрации раствора NH4SCN
Концентрацию раствора роданида аммония NH4SCN устанавливают по первичному стандартному раствору 0,04 н хлорида натрия, применяя метод обратного титрования.
Раствор NH4SCN наливают в бюретку и устанавливают уровень жидкости по нижнему мениску на нуле. В колбу для титрования пипеткой наливают 10 мл раствора AgNO3, 5 мл 4 н азотной кислоты (отмеривают цилиндром) – 10-15 капель индикатора. Полученный раствор титруют раствором роданина аммония до появления бледно-розового окрашивания. Титрование повторяют 2-3 раза, для расчета берут средний результат.
Обозначим объем NH4SCN, пошедший на титрование 10 мл AgNO3, – V1 мл. Далее в колбу для титрования пипеткой берут 10 мл первичного стандартного раствора NaCl, прибавляют пипеткой 10 мл раствора AgNO3, 5 мл 4 н HNO3, 10-15 капель индикатора и, хорошо перемешивая полученную смесь, титруют раствором NH4SCN до появления розового окрашивания. Титрование повторяют 2-3 раза.
Обозначим объем NH4SCN, пошедший на титрование этой смеси – V2 мл. Этот объем соответствует тому количеству AgNO3, которое осталось после реакции всего прибавленного AgNO3 с хлоридом натрия. Отсюда (V1-V2) – объем роданида аммония, эквивалентный взятому количеству хлорида натрия. При титровании идет следующая реакция:
NaCl + AgNO3 = AgCl(т) + NaNO3 + (AgNO3)
избыток остаток
AgNO3 + NH4SCN = AgSCN(т) + NH4NO3
остаток
Fe3+ + 3NH4SCN → Fe(SCN)3 + NH4+
красное окрашивание
Нормальность раствора NH4SCN определяют из соотношения:
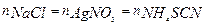 

3. Определение содержания NaCl в растворе
Полученный в мерной колбе емкостью 100 мл раствор NaCl (задача) разбавляют дистиллированной водой до метки и тщательно перемешивают. Затем в колбу для титрования пипеткой помещают 10 мл этого раствора, прибавляют пипеткой 10 мл раствора AgNO3, 5 мл 4 н HNO3, 10-15 капель индикатора и титруют раствором NH4SCN до появления розового окрашивания 2-3 раза. Объем раствора NH4SCN, пошедший на титрование, обозначим V3.
Расчет проводят по следующим формулам:

QNaCl = NNaCl ·Vк ·ЭМ, мг
где ЭМNaCl – Мол.масса = 58,443;
Vк – объем мерной колбы (100 мл).
|