
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
RedOX процессы. РедоксиметрияСодержание книги
Поиск на нашем сайте
Широко используются в качественном анализе, например, Mn2+ открывают с помощью характерной реакции окисления до розово-фиолетового MnО4−. Cr3+ обнаруживают по желтой окраске CrО42−, оранжевой Сr2O72− или синей окраске надхромовой к-ты Н2СrО6 в неводном растворителе. Избирательное окисление применяют для разделения ионов, например, из смеси Cr(OH)3 + Fe(OH)3 хром переводят в раствор окислением в щелочной среде до CrО42−. Окислительно-восстановительные процессы в количественном анализе – это титриметрические методы редоксиметрии (хроматометрия, перманганатометрия, иодометрия и т.д.), а также редокс индикаторы, у которых окраска меняется при достижении определенного значения окислительно-восстановительного потенциала системы. Например, бесцветный дифениламин NH(C6H5)2 в присутствии окислителей окрашивается в сине-фиолетовый цвет. Переход цвета происходит в некотором интервале значений потенциала от Eо индикатора. Перманганатометрия Основная реакция: MnO4−+5ē+8H+ ↔ Mn2++4H2O. Стандартный окислительно-восстановительный потенциал системы Первичный стандартный раствор: 1. Н2С2О4·2Н2О – щавелевая кислота, 0,02н раствор.
Реакция: С2О42− − 2ē ↔ 2СО2. 2. Na2С2О4 − оксалат Na, щавелевокислый Na, 0,02н раствор.
Иодометрия Основная реакция: I2 + 2ē ↔ 2I−. Йод – окислитель, йодид − восстановитель. Индикатор (специфический) − 5% раствор крахмала. Первичный стандартный раствор: Дихромат калия К2Cr2O7, 0,02н раствор. Реакция: Cr2O72− + 6ē + 14 H+ ↔ 2Cr3+ + 7H2O.
Вторичный стандартный раствор (титрант): 1. Тиосульфат натрия Na2S2O3·5H2O, 0,02н раствор. Реакция: S4O62− + 2ē ↔ 2S2O32−, Этс = Мтс = 248,19 г/экв. 2. Йод I2, 0,02н раствор. Рекция: I2 + 2ē ↔ 2I−,
Вспомогательный раствор: 10% KI; 2н Н2SO4. Индикатор: 0,5% раствор крахмала. Определяемые вещества: 1. Окислители. Определяют методом замещения, например, дихромат калия; nдх = n К2Cr2O7 + 6KI + 7Н2SO4 → Сr2(SO4)3 + 3I2 + 4К2SO4 +7H2O 3I2 + 2Na2S2O3 → 2NaI + Na2S4O6. 2. Восстановители. Определяют обратным титрованием, например, сульфит натрия; nсн = n Na2SО3 + I2 + H2O → 2HI + Na2SO4 (+ избыток I2) I2 (избыток) + 2 Na2S2O3 → 2NaI + Na2S4O6. Комплексонометрия Основная реакция: Na2H2EDТА + Ме2+ → Na2МеEDТА + 2Н+. Первичные стандартные растворы: Сульфат магния MgSO4, оксид магния MgO, оксид цинка ZnO, 0,01н растворы.
Вторичный стандартный раствор: Двунатривая соль этилендиаминтетрауксусной кислоты (трилон Б, комплексон-III) Na2H2EDТА•2Н2О (или Na2H2ЭДТА•2Н2О), 0,05н раствор.
Структурная формула трилона Б:
Фиксирование ТЭ осуществляют индикаторным методом с применением металлоиндикаторов H2R. Это слабые органические кислоты, образующие неустойчивые окрашенные комплексы с катионами металлов, которые разрушаются в присутствии более сильных лигандов, входящих в комплексон. Титрование проводят в буферном слабощелочном растворе. Mg2+ + H2R(синий) ↔ MgR(розовый) + 2H+ MgR(розовый) + Na2H2EDТА ↔ Na2MgEDTA + Н2R(синий) Определяемые вещества: 1. Катионы, например, Са2+, Mg2+, Al3+, Fe3+, Tl4+ − прямым титрованием; 1. Анионы − обратным титрованием;
Вопросы 1. Сущность гравиметрического анализа. 2. Как достигается полнота осаждения осаждаемой формы? 3. Требования к гравиметрической форме в весовом анализе. 4. Методы объемного анализа по типам используемых реакций. 5. Требования к веществам для титрованных растворов. 6. Какие кислотно-основные индикаторы вы знаете? 7. От чего зависит внешний вид кривой титрования? 8. Что отражено в термине перманганатометрия? 9. Как используют заместительное титрование в йодометрии? 10. Какие вещества называют комплексонами?
Практические задания 1. Рассчитать массу силикатной породы, содержащей 7% СаО, которая необходима для получения 0,5 г СаSO4. Ответ: а) 2,94 г; б) 5,36 г. 2. На титрование навески 0,1560 г х.ч. янтарной кислоты Н2С4Н4О4 израсходовано 25,00 мл гидроксида натрия. Вычислить нормальность раствора гидроксида натрия и его титр по соляной кислоте ТNaOH/HCl. а) NNaOH = 0,1058 моль экв/л; б) TNaOH/HCl = 0,003862 г/мл. 3. Навеску m=0,5000 г известняка растворили в 25,00 мл 0,5100 N раствора соляной кислоты. Избыток кислоты оттитровали 6,5 мл 0,4900 N раствора NaOH. Вычислить массовое процентное содержание карбоната кальция CaCO3 в известняке. а) ωCaCO б) ωCaCO 4. Из 0,5100 г руды медь после ряда операций была переведена в раствор в виде соли меди (II). При добавлении к этому раствору избытка иодида калия выделился иод, на титрование которого пошло 14,10 мл тиосульфата натрия Na2S2O3·5H2O c титром по меди Т ТС/Сu=0,006500 г/мл. Сколько весовых процентов меди содержит руда? а) ωси=20,05%; б) ωси=17,97%.
Примеры решения задач 1. Вычислить фактор пересчета для определения NH3, если после осаждения его в виде (NH4)2PtCl6 получена гравиметрическая форма Pt. Решение 1 моль Pt образуется из 1 моль (NH4)2PtCl6, на образование которого идут 2 моль NH3. Фактор пересчета равен:
Ответ: F=0,174.
2. Из 1,450 г технического Na2SO3 приготовили 200 мл раствора. На титрование 20,0 мл его израсходовали 16,2 мл 0,0124 N раствора йода. Определить процентное содержание Na2SO3 в образце. Решение Приведен пример прямого титрования с протекающей реакцией Na2SO3 +I2 + H2O = Na2SO4 + 2HI. По закону эквивалентов
Это составляет:
Это масса сульфита в 20 мл раствора, в 200 мл – Процентное содержание
Ответ: Литература 1. Основы аналитической химии. Практическое руководство (под ред. Ю.А. Золотова). М.: Высшая школа, 2006, 460 с. 2. Коренман Я.И. Практикум по аналитической химии. М.: Колос, 2005, 237с. 3. Коренман Я.И., Суханов П.Т. Задачник по аналитической химии. Воронеж: ВГТА, 2004, 339 с. 4. Цитович И.Е. Курс аналитической химии. - М.: Высшая школа, 1994, 495 с. 5. Васильев В.П. Аналитическая химия. - М.: высшая школа, 1989, Т. 1, 384 с. 6. Логинов Н.Я., Воскресенский А.Г., Солодкин И.С. Аналитическая химия. - М.: Просвещение, 1979,479 с. 7. Крешков А.П. Основы аналитической химии. - М.: Химия, 1970, 471 с. 8. Бончев П.Р. Введение в аналитическую химию. - Л.: Химия, 1978,496 с.
|
||||||||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 774; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.17.175.167 (0.009 с.) |

 .
. г/экв.
г/экв. г/экв.
г/экв. г/экв.
г/экв.
 из бесцветного окисляется в сине-фиолетовый.
из бесцветного окисляется в сине-фиолетовый.
 г/экв.
г/экв. .
. .
.
 = nтc.
= nтc.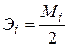 .
.
 ,
, .
. .
. =87,3%;
=87,3%; .
.


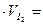 0,0124·16,2·10–3=2,01·10–4 моль.
0,0124·16,2·10–3=2,01·10–4 моль.
 .
. .
.



