
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Вольтамперометрические методы анализаСодержание книги
Поиск на нашем сайте
Вольтамперометрические методы включают группу методов, основанных на расшифровке вольтамперограмм – кривых зависимости от величины приложенного потенциала силы тока в электролитической ячейке с погруженными в анализируемый раствор поляризующимся индикаторным микроэлектродом и неполяризующимся электродом сравнения. Вольтамперограмма позволяет получить не только качественную и количественную информацию о присутствующих в растворе веществах, окисляющихся или восстанавливающихся на индикаторном электроде, но и охарактеризовать протекающие электродные процессы. Раздел вольтамперометрии, в котором в качестве индикаторного электрода используют капающий ртутный электрод, называют полярографией.
5.2.1. Классическая полярография Для регистрации классических полярограмм ячейку с капающим ртутным индикаторным электродом и электродом сравнения, содержащую анализируемый раствор, через калиброванное линейное сопротивление присоединяют к источнику постоянного напряжения (например, аккумуляторной батарее на 4 – 6 В) и, изменяя величину потенциала со скоростью 2 – 5 мВ/с, измеряют силу тока в цепи электролизера. Для обеспечения достаточно высокой электропроводности раствора в ячейку помещают 0,05 – 1,0 М раствор индифферентного электролита (фона), который не подвергается электрохимическим реакциям в выбранной области потенциалов. При наличии в растворе ионов, способных восстанавливаться или окисляться при достижении определенного потенциала, в момент их разряда на электроде возникает ток. Для измерения силы тока в электрическую цепь включают гальванометр. Достоинствами капающего ртутного электрода являются постоянное обновление поверхности электрода, хорошая воспроизводимость площади поверхности и, соответственно, практически абсолютная воспро-изводимость полярограмм, а также почти идеальная поляризуемость в широком интервале потенциалов (от +0,4 В до -2,5 В в зависимости от природы фона). Это позволяет изучать и определять вещества, восстанавливающиеся при очень высоких отрицательных потенциалах, что невозможно на электродах из других материалов. Перед регистрацией полярограммы при необходимости удаляют растворенный кислород, являющийся электроактивным, насыщая раствор инертным газом (например, азотом) или добавляя в него сульфит натрия (в щелочных растворах).
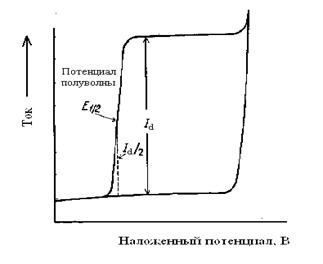
Классическую полярограмму характеризуют три параметра: величина предельного диффузионного тока Id, мкА (или пропорциональная величина – высота волны, мм), потенциал в точке максимального наклона E1/2, В (потенциал, при котором ток равен половине диффузионного), называемый потенциалом полуволны, и наклон, мВ. При этом потенциал полуволны Е1/2 является характерной для данного вещества величиной (качественной характеристикой), а величина предельного тока Id пропорциональна концентрации определяемого вещества в растворе (количественная характеристика). При одновременном присутствии в растворе нескольких веществ с различными потенциалами восстановления или окисления на регистрируемой вольтамперной кривой наблюдают несколько волн, соответствующих разряду каждого из них, если потенциалы полуволн компонентов различаются не меньше, чем на 350/n мВ. По величинам потенциалов полуволн можно установить качественный состав раствора. Зависимость величины диффузионного тока от концентрации восстанавливающегося вещества в полярографии выражается уравнением Ильковича: Id = 605nD1/2m2/3t1/6c, где Id – предельный диффузионный ток, мкА; n – число электронов; D – коэффициент диффузии, см2/с; m – скорость вытекания ртути, мг/с; t – период капания, с; с – концентрация, мМ. В упрощенном виде уравнение Ильковича можно записать так: Id = kc В практике количественного полярографического анализа применяют главным образом методы стандартов, градуировочного графика и добавок. Полярография является удобным методом определения ионов металлов, установления структуры и определения органических соединений.
|
||||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 647; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.223.158.29 (0.006 с.) |




