
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Определение нитратов в экстрактах пищевого сырьяСодержание книги
Поиск на нашем сайте
В настоящей работе используется ионоселективный мембранный электрод. Корпус электрода заполняется приэлектродным раствором с молярной концентрацией 10-1 моль/см3 KNO3 и 5. 10-3 моль/см3 KCl. Принцип работы электрода основан на том, что при погружении электрода в р-р происходит обмен ионами между поверхностью ионочувствительной мембраны и раствором. Между поверхностью мембраны и измеряемым раствором возникает разность потенциалов, значение которой пропорционально-lgCNO Контролируемая среда не должна образовывать пленок и осадков на рабочей части (мембране) электрода и не должна содержать ионы Br- и J-. Допускается применение электрода в средах, образующих легкосмываемые водой осадки. Электрод селективен в присутствии ионов Cl-, HCO3-, CH3COO-, F-, SO42-, соответственно при концентрациях не превышающих концентрацию ионов NO3- в 100, 500, 500, 1000 раз. Индикаторный электрод ЭМ –NO3- - 0.1 и хлорсеребряный электрод сравнения погружают в исследуемый раствор, подключают электроды к иономеру ЭВ-74. Диапазон линейности электродной характеристики электрода соблюдается от 0.35 до 4.0 pNO3 при прямых потенциометрических измерениях и от 0.17 до 5.0 pNO3 при потенциометрическом титровании, причем рН контролируемых сред от 2 до 9. Отклонение электродной характеристики от линейности в диапазоне 0,35 до 4,0 pNO3 не превышает +12 мв. Для этого используют контрольные растворы для калибровки электродов.
1 моль/дм3 KNO3 1 . 10-3 моль/дм3 KNO3 1 . 10-1 моль/дм3 KNO3 1 . 10-4 моль/дм3 KNO3 1 . 10-2 моль/дм3 KNO3
Перед калибровкой промыть три раза измерительный электрод в дистиллированной воде при перемешивании, меняя воду через каждые 5 мин. Затем электрод дважды промыть контрольным раствором, с которого предусмотрено начать калибровку. Калибровку производить от низших концентраций к высшим. При переходе к растворам высшей концентрации электрод промыть контрольным раствором. Подготовленные электроды помещают в исследуемый раствор и снимают показания со шкалы иономера ЭВ-74 в мв не менее, чем через 1 мин, после прекращения дрейфа показаний прибора. Температура анализируемых проб и растворов сравнения должна быть одинаковой. Результаты калибровки электрода вносят в таблицу 2. Таблица 2 Значения pNO3 (-lgCNO3-) контрольных растворов при температуре от 0 до 50º С и потенциал электрода (мв) в растворе KNO3 1.10-3 моль/кг
По полученным данным строят градуировочный график в координатах Е, МВ – pNO3.На оси абсцисс откладывают значение pNO3, на оси ординат Е, мв. Допустимое отклонение точек от прямой, характеризующей электродную функцию, не должно превышать ±6мв. По графику определяется крутизна характеристики – число милливольт на единицу рNO3 – мв/рNO3. Крутизна электродной характеристики составляет 56,5+3,0 МВ/pNO3 при температуре 25ºС. Откалиброванный электрод в паре с электрод сравнения готов к работе. Перед определением концентрации нитрат- ионов в исследуемых пробах проводят настройку прибора ЭВ-74 по двум растворам, соответствующим началу и концу измеряемого диапазона pNO3. После этого приступают к измерениям неизвестной концентрации нитратов в исследуемых образцах. Подготовка пробы анализируемого образца: клубни картофеля, огурцы, капуста, свекла, томаты, фрукты, бахчевые культуры, зерно. Анализируемыеобразцы овощей, фруктов, бахчевых культур измельчают на терке до размера частиц не более 1 см. Зерно измельчают на лабораторной электрической мельнице. К 1 г измельченного анализируемого образца приливают 50 мл 1% раствора алюмо–калиевых квасцов и гомогенизируют в течение 3 минут. (При отсутствии гомогенизатора проводят экстракцию на встряхивателе в течение 5 минут). В полученную суспензию погружают электроды и измеряют Е, МВ. По градуировочному графику определяют pNO3-. Находят С(NO3-) моль/дм3 Рассчитывают содержание нитратов в мг/кг Х= Н-навеска пробы, г. Чувствительность метода 6мг/кг По окончании работы электрод промывают в дистиллированной воде. Электрод ЭМ-NO3-01 хранят в растворе 0,1 KNO3. Если перерыв в работе составляет более 5 дней, электрод хранят на воздухе. Электрод сравнения хранят в дистиллированной воде.
К О Н Д У К Т О М Е Т Р И Я
Кондуктометрический метод анализа основан на измерении электрической проводимости (электропроводности) растворов электролитов. Растворы электролитов обладают способностью проводить электрический ток под действием электрического поля. Двигающиеся в растворе ионы в поле электрического тока испытывают тормозящее действие со стороны молекул растворителя и окружающих противоположно заряженных ионов. Это так называемый релаксационный и электрофоретический эффекты. Результатом такого тормозящего действия является сопротивление раствора прохождению электрического тока. Электропроводность раствора W обратна его электрическому сопротивлению R: W = где W – электропроводность раствора, Ом-1 или См (сименс), R – электрическое сопротивление раствора, Ом Для измерения электропроводности растворов используются электроды, погруженные в этот раствор. Сопротивление раствора обратно пропорционально площади электродов S (см2) и прямо пропорционально расстоянию между ними R = где Если принять В аналитических целях величина “электропроводность – W” как таковая используется крайне редко, поскольку электропроводность любого проводника – раствора или металла – зависит от его размеров и форм. Чтобы не учитывать зависимость электропроводности от размеров проводника, пользуются понятием “удельная электропроводность
Удельная электропроводность Удельная электропроводность соответствует электропроводности раствора объемом в 1 см3, находящегося между электродами площадью 1 см2, расположенным на расстоянии 1 см друг от друга.х) Для разбавленных растворов удельная электропроводность изменяется пропорционально концентрации. Поэтому в расчетах удобно пользоваться эквивалентной электропроводностью. Эквивалентной электропроводностью называют проводимость раствора, содержащего 1 моль эквивалента вещества и находящегося между двумя параллельными электродами, расстояние между которыми 1 см. Единицей измерения Удельная и эквивалентная проводимость взаимно связаны соотношением:
где С – молярная концентрация эквивалента, моль/л. Подвижность ионов имеет постоянное максимальное значение при бесконечном разбавлении раствора, поэтому эквивалентная электропроводность раствора электролита при бесконечном разбавлении представляет собой постоянную величину, равную сумме подвижностей ионов при бесконечном разбавлении:
где Если ион несет более одного заряда, то значение подвижности иона относят к одному заряду. Когда в растворе присутствует больше, чем два вида ионов или смеси любых электролитов, эквивалентная электропроводность определяется уравнением Кольрауша:
Закон аддитивности электрической проводимости растворов электролитов при бесконечном разведении где: С – общая концентрация электролита, Сi –концентрация, I – ого вида ионов, Zi - заряд ионов,
х) Примечание - Формулы, обозначения и размерности некоторых величин в системах СИ и СГС сведены в таблицу 3. Таблица 3
Аномально высокая подвижность ионов водорода и гидроксида в водных растворах объясняется особым механизмом передвижения этих ионов. Известно несколько методов кондуктометрического анализа. Методом прямой кондуктометрии концентрация вещества определяется по электрической проводимости раствора, если между ними существует прямая пропорциональность и, в основном, для анализа однокомпонентных систем. Прямую кондуктометрию используют сравнительно редко, поскольку регистрируемый аналитический сигнал избирателен: электропроводность-величина аддитивная, определяемая наличием всех ионов в растворе. Прямые кондуктометрические измерения успешно используют, например, для оценки чистоты растворителя, речных и минеральных вод, а также для определения констант диссоциации электролитов, состава и константы устойчивости комплексных соединений, растворимости малорастворимых электролитов. Большое распространение в аналитической практике получил метод кондуктометрического титрования, основанный на использовании химической реакции, в результате которой происходит заметное изменение электропроводности раствора. При кондуктометрическом титровании могут быть использованы химические реакции всех типов. Кондуктометрическое титрование обладает рядом достоинств: возможно дифференцированное титрование смесей ряда кислот или оснований, титрование мутных, окрашенных растворов, а также возможно титрование при образовании гидролизующихся солей. Нижний предел определяемых концентраций 10-4 моль/л, погрешность определений 2%. При кондуктометрическом титровании происходит замещение ионов, находящихся в анализируемом растворе и участвующих в реакции с титрантом, ионами титранта, подвижностью которых больше или меньше подвижности ионов анализируемого раствора. Этим обусловлено получение восходящих или нисходящих ветвей кривых кондуктометрического титрования. Точность установления точки эквивалентности определяются углом пересечения прямых: угол должен быть как можно меньше, так как только в этом случае наблюдается излом на кривой титрования. Наиболее острый угол пересечения прямых получается при кислотно-основном титровании, так как ионы Н+ и ОН- вносят особенно большой вклад в электропроводность раствора. Наряду с реакциями кислотно-основного взаимодействия в кондуктометрии можно применять реакции осаждения, комплексообразования, окисления-восстановления. В кислотно-основном титровании возможны следующие случаи (см. рис.9, 10, 11).
Рис.10. Кривые титрования слабой кислоты а) сильным основанием, б.) слабым основанием
При осадительном титровании катион или анион анализируемого раствора образует осадок с анионом (или соответственно катионом) титранта. Кондуктометрическое титрование обладает рядом преимуществ. Его можно проводить в мутных и окрашенных средах, а также в присутствии окислителей и восстановителей, ограничивающих применение кислотно-основных индикаторов. Метод обладает повышенной чувствительностью и позволяет анализировать разбавленные растворы (до 10-4); более точно устанавливается конечная точка при титровании слабых кислот и оснований. РАБОТА № 11
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 904; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.143.7.53 (0.008 с.) |

 - или pNO3 измеряемого раствора. Потенциал электрода измеряют по отношен к вспомогательному электроду сравнения (например ЭВЛ 1МЗ), в комплекте с рН-, милливольтметрами, высокоомными измерительными преобразователями, иономерами и рН 121.
- или pNO3 измеряемого раствора. Потенциал электрода измеряют по отношен к вспомогательному электроду сравнения (например ЭВЛ 1МЗ), в комплекте с рН-, милливольтметрами, высокоомными измерительными преобразователями, иономерами и рН 121.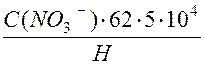 (мг/кг); где:
(мг/кг); где: (1)
(1) (см):
(см): (2)
(2)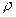 - коэффициент пропорциональности, называемый удельным сопротивлением, Ом . см;
- коэффициент пропорциональности, называемый удельным сопротивлением, Ом . см; ”. Удельная электропроводность
”. Удельная электропроводность  (3)
(3) является См.см2/моль экв. (СИ).
является См.см2/моль экв. (СИ). , (4)
, (4) (6)
(6)

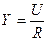 ; U=Y · R
; U=Y · R







