
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Определение содержания серной кислотыСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Реагенты Щавелевая кислота H2C2O4·2H2O; 0,1 н раствор (первичный стандарт) (или КОН); 0,1 н раствор (вторичный стандарт, титрант) Гидроксид натрия – NaOH Индикатор – фенолфталеин. Установление концентрации раствора NaOH Концентрацию (N, Т) NaOH устанавливают по первичному стандартному раствору исходного вещества, например, по щавелевой кислоте. Щавелевая кислота диссоциирует по двум ступеням: H2C2O4 ↔ H+ + HC2O-4 (pK1 = 1,25) HC2O-4 ↔ H+ + C2O2-4 (pK2 = 4,27) Значения рК сравнительно мало отличаются друг от друга, поэтому при титровании водных растворов щавелевой кислоты гидроксидом натрия реакция протекает по уравнению: H2C2O4 + 2ОН- ↔ C2O2-4 + 2Н2О Из уравнения следует, что грамм – эквивалент H2C2O4·2Н2О равен: ЭМщ.к. = Вследствие гидролиза образующегося оксалата натрия в ТЭ раствор должен быть щелочным. При титровании 0,1 н раствор должен быть щелочным. При титровании 0,1 н раствора щавелевой кислоты 0,1 н раствором гидроксида натрия в ТЭ рН = 8,55. Следовательно, для этого случая титрования пригоден фенолфталеин (интервал перехода рН = 8 Бюретку тщательно промывают водой и дважды ополаскивают приготовленным раствором NaОН; затем, подставив под нее колбу или стакан, открывают зажим и заполняют раствором оттянутый кончик бюретки, чтобы в нем не оставалось пузырьков воздуха. Устанавливают уровень NaOН в бюретке на нуле. Дважды ополаскивают пипетку стандартным раствором щавелевой кислоты, после чего отмеренные пипеткой 10 мл раствора щавелевой кислоты переносят в коническую колбу. К раствору щавелевой кислоты прибавляют 2-3 капли индикатора фенолфталеина и титруют при непрерывном перемешивании раствором гидроксида натрия до тех пор, пока в перемешанном после прибавления капли NaOH растворе бледно-розовая окраска будет сохраняться около 30 секунд. Титрование проводят не менее трех раз до получения сходящихся результатов (отсчеты должны различаться не более, чем на ± 0,1 мл). По результатам титрования нахордят среднее значение, по которому рассчитывают точную концентрацию титранта NaOH по формуле: nщ.к. = nNaOH Nщ.к. · Vщ.к. = NNaOH · VсрNaOH NNaOH = Определение содержания серной кислоты в растворе Получив в мерной колбе некоторое количество раствора серной кислоты, доводят объем дистиллированной водой до метки и тщательно перемешивают раствор. Ополаскивают пипетку приготовленным раствором серной кислоты, отбирают пипеткой 10 мл этого раствора в коническую колбу и добавляют 2-3 капли фенолфталеина. Титрант - раствор гидроксида натрия NaOH – наливают в бюретку и устанавливают уровень раствора на нуле. Кончик бюретки заполняют раствором NaOH. Раствор кислоты титруют при перемешивании раствором NaOH до неисчезающего в течение 30 секунд бледно-розового окрашивания. Титрование повторяют 2-3 раза. Расчет производят по формулам: n N Q ЭМ
II. Р Е Д О К С И М Е Т Р И Я ПЕРМАНГАНАТОМЕТРИЯ
Основная реакция: MnO-4 + 5e + 8H+ → Mn2+ + 4H2O
ПЕРМАНГАНАТОМЕТРИЯ
РАБОТА№ 5
|
||||||||||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 1023; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 13.58.203.104 (0.007 с.) |


 10).
10).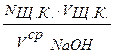 .
. , г/мл
, г/мл = n
= n 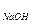 ;
;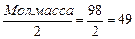
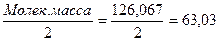
 2.) Na2C2O4 – оксалат натрия; 0,02 н. раствор;
ЭМ =
2.) Na2C2O4 – оксалат натрия; 0,02 н. раствор;
ЭМ = 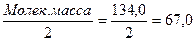
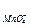 + 8H+/Mn2+ +4H2O = + 1,51 В;
ЭМ =
+ 8H+/Mn2+ +4H2O = + 1,51 В;
ЭМ = 
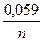 (п – число электронов)
Пример: дифениламин, изменяющий окраску при Е = + 0,76 ± 0,1 В
(бесцветная форма окисляется, возникает сине-фиолетовое окрашивание). Дифениламин применяют при титровании очень разбавленным KMnO4
(п – число электронов)
Пример: дифениламин, изменяющий окраску при Е = + 0,76 ± 0,1 В
(бесцветная форма окисляется, возникает сине-фиолетовое окрашивание). Дифениламин применяют при титровании очень разбавленным KMnO4



