
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Определение рН вина, сока (активной кислотности)Содержание книги
Поиск на нашем сайте
Определение кислотности вин и соков потенциометрическим методом имеет важное значение для пищевой технологии. По величинам общей (титруемой) и активной кислотности на всех этапах производства можно судить о качестве сырья и продукции, режиме ее хранения. Все кислоты в водных растворах распадаются (диссоциируют) на ионы водорода и кислотного остатка. Так сильные кислоты (Н2SO4, HCl) диссоциируют почти полностью с высокой степенью диссоциации, а слабые (винная, лимонная, яблочная, уксусная и др.) в очень малой степени, чаще выражаемой константой диссоциации. Для сильных кислот в водных растворах диссоциация практически необратима:
или
α (степень диссоциации) = число распавшихся молекул ×100
Для слабых кислот диссоциация обратима (равновесие):
[СН3СООН] = 1,7 × 10-5
В отличие от общей титруемой кислотности, обусловливаемой совместным присутствием сильных и слабых кислот в вине, соке, активная кислотность выражается концентрацией лишь сильных диссоциированных кислот и определяется непосредственно как рН объекта. В свою очередь, рН раствора отражает не всю номинальную концентрацию растворенных сильных кислот "Сн+", а лишь концентрацию их подвижных ионов "Н+" "α Н", называют активной.
Поэтому активная концентрация сильных кислот, выражаемая рН, оказывает влияние на степень кислотности ("силу кислотного вкуса") вина и соков гораздо больше, чем даже высокое содержание слабых кислот. Из слабых кислот (лимонная, яблочная и др.) наибольшей кислотностью обладает винная кислота. рН вина, выражающий его активную кислотность, определяют по показаниям потенциометра (рН-метра), иономера. Потенциометр включен в общую схему с электродами стеклянным (I рода) и хлорсеребрянным (II рода), погружаемыми в образец исследуемого вина.
Выполнение работы Приборы: Потенциометр (рН-метр), иономер, электроды - хлорсеребряный (сравнения) и стеклянный (индикаторный). Посуда: I. Стаканчик на 50 см3. II. Мерный цилиндр на 50 см3. Реактивы: буферный раствор, рН = 4,01. Подготовка прибора Включают рН-метр тумблером в электросеть и после 30 мин прогревания настраивают шкалу рН (верхняя шкала прибора) по буферному раствору с рН около 4 (для кислотного диапазона). Техника определения Электроды промывают дистиллированной водой, следы ее удаляют фильтровальной бумагой и погружают электроды в стакан на 50 см3 со стандартным буферным раствором; переключатель "Виды работ" устанавливают в положение "рН", переключатель пределов измерения устанавливают на диапазон рН 2-6. Рукояткой "Настройка по буферному раствору" устанавливают стрелку шкалы на значение рН стандартного буферного раствора, (например, рН = 4,01) и проверяют устойчивость показаний в диапазоне 2÷14 рН. Затем выливают буферный раствор, промывают электроды и стакан дистиллированной водой, ополаскивают их образцом исследуемого вина,.наливают 25 см3 вина в стакан и погружают электроды. Вначале устанавливают переключателем пределов измерения широкий диапазон измерения рН 2-14, приблизительно оценивают значение рН по показаниям стрелки и после установки переключателем узкого диапазона рН 2-6 фиксируют точное значение рН. Работа № 9.2. Потенциометрическое определение титруемой кислотности вина (сока) Величина титруемой кислотности вина, соков, плодов и ягод зависит от общего содержания в них свободных сильных и слабых кислот и их кислых солей. Такая кислотность определяется титрованием щелочью образца вина, сока, водной вытяжки плодов (ягод), либо с помощью индикатора (визуально), либо потенциометрически. Потенциометрический метод позволяет титровать и устанавливать точку эквивалентности даже сильно окрашенных: объектов (вин, соков), когда применение обычных кислотно-основных индикаторов (фенолфталеина, метилоранжа к др.) невозможно. Благодаря этому потенциометрический метод получает все более широкое применение в заводских аналитических лабораториях. При титровании щелочью кислот вина (сока) происходит как кислотно-основное взаимодействие (увеличение рН вина), так и окислительно-восстановительные реакции (восстановление вина и уменьшение его потенциала).
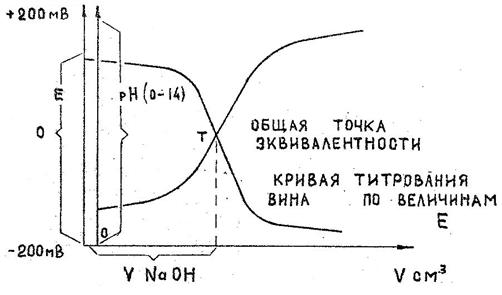
Рис. 8 Кривые титрования кислот вина (сока).
Каждую из этих реакций можно выразить графически в виде соответствующей кривой титрования – кривой изменения рН или кривой изменения потенциала Е.
Точки эквивалентности каждой из них, лежащие на серединах скачков титрования, при пересечении кривых совмещаются в одну, что и соответствует практическим результатам (см. рис.8). Действительно, независимо от метода фиксации точки эквивалентности, ее положение относительно оси абсцисс должно быть неизменно, т.к. на нейтрализацию кислот исследуемого образца затрачивается строго определенный объем титранта (щелочи). Измерение потенциометром либо значений Е, либо значений рН и последующее графическое построение любой из двух кривых приводит к нахождению точки эквивалентности и объема израсходованной щелочи (см. рис.8). По найденному объему щелочи рассчитывают по правилу эквивалентов концентрацию кислот в объекте, а затем и общую кислотность. Применение хингидронного электрода дает возможность измерять более широкий диапазон значений Е, что повышает точность графического определения объема титранта, а значит и общего результата. Титруемую кислотность вин выражают либо в г/дм3 (промилле) в пересчете на винную кислоту, либо в г-экв/дм3 всех кислот вина, в том числе органических. Значение потенциала вина в ходе его титрования порциями щелочи определяют по показаниям нижней шкалы потенциометра (милливольтметра) ЛПУ - 01. Выполнение работы Потенциометр включен в общую электросхему с электродами - хингидронннм (I рода) и хлорсеребряным (II рода), погруженными в образец исследуемого вина, помещенный на магнитную мешалку. На отдельном штативе закреплена бюретка с 0,1 н.раствором щелочи для титрования вина. Приборы: 1. Потенциометр ЛЛУ-01, электроды - хлорсеребряный (сравнения), хингидронный (индикаторный). 2. Электромагнитная мешалка. Реактивы: 0,1 н.водный раствор NаОН. Посуда: I. Стакан для титрования на 150 см3 2. Мерный цилиндр на 50 см3 3. Пипетка на 10 см3 4. Бюретка на 25 см3 или на 50 см3 Техника определения В стакан для титрования отмеряют пипеткой 10 см3 вина (сока), 50 см3 дистиллированной воды и раствор нагревают до кипения для удаления углекислоты во избежание повышенного расхода щелочи на титрование. Охладив раствор, опускают в стакан мешалку для перемешивания, добавляют туда на кончике ножа хингидрон, опускают электроды и ставят стакан на магнитную мешалку; включают последнюю и приступают к титрованию вина (сока) 0,1 н раствором NаОН, приливая его из бюретки по 0,5 см3. После каждого прибавления порции щелочи для выравнивания концентрации раствор перемешивают в течение 0,5 мин., после чего снимают показания прибора в мВ. После резкого скачка потенциала добавляют еще несколько порций раствора NаОНпо I см3 и ведут титрование до показания прибора 200 мВ. Результаты титрования вносят в таблицу 1. Таблица 1
По полученным данным строят кривую титрования (рис.7.) в следующих координатах: на оси ординат откладывается разность потенциалов в мВ, а на оси абсцисс число см3 раствора NаОН (его получают путем суммирования отдельных порций по 0,2 см3). Примерный вид кривой потенциометрического титрования приведен на рис.7. Количество см3 щелочи, пошедшее на титрование, определяется графически. Для этого к кривой титрования в точках перегиба А и Б строят касательные, параллельные друг другу. Восстанавливают между ними перпендикуляр ВБ находят его середину (точка Е) и проводят через нее прямую, параллельную двум касательным, до пересечения с кривой-титрования в точке D. Из точки D опускают перпендикуляр DМ на ось абсцисс. Отрезок прямой СМ равен количеству см3 щелочи, пошедшей на титрование. Расчет Так как I см3 0,1н раствора щелочи соответствует 0,0075 г винной кислоты, то титруемая кислотность рассчитывается по формуле: А = 0,75× а × в, где А - содержание винной кислоты, г/дм3; а - количество см3 0,1 н раствора щелочи, пошедшее на титрование 10 см3 вина (по графику); в - поправочный коэффициент к величине нормальности щелочи (в случае точно 0,1 н раствора в = 1). При выражении результатов определения в г-экв/дм3 кислотность вычисляется по формуле: В = 0,0001 × а × в × 100 = 0,01× а × в.
Рис.7 Кривая потенциометрического титрования кислот вина (сока). где ВВ1 и ГГ1 – касательные к точкам перегиба кривой. Подготовка прибора Включают прибор в электросеть, переключатель «Виды работ» устанавливают в положение 200÷ +1400 МВ и после 30 мин прогревания приступают к титрованию вина.
ИОНОМЕТРИЧЕСКИЙ МЕТОД АНАЛИЗА Ионометрический метод анализа основан на прямом измерении электродвижущей силы (ЭДС) в системе, зависящей от концентрации потенциалопределяющего иона и относится к потенциометрическим методам анализа. Ионоселективным электродом (ИСЭ) называется электрод, потенциал которого определяется преимущественно активностью одного единственного иона и слабо зависит от активности других, мешающих ионов. Чувствительным элементом любого электрода является селективная мембрана, разность потенциалов (концентрационная разность потенциалов) по обе стороны которой линейно зависит от логарифма активности потенциалопределяющего иона в соответствии с уравнением Нернста. Конструктивно ИСЭ подобны рН – электродам. Широкое применение при анализе пищевых продуктов получил нитрат-селектиновый электрод. Токсичность нитратов вызвана тем, что в живом организме нитраты превращаются в нитриты, которые способны взаимодействовать с гемоглабином крови, превращая его в неактивную форму метагемоглабина.
РАБОТА № 10
|
||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 1819; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.117.91.116 (0.006 с.) |

 HCl H+ + Cl-
HCl H+ + Cl- Н2О + Н+ Н3О+
Н2О + Н+ Н3О+ общее число молекул (в %)
общее число молекул (в %)
 СН3СООН Н+ + СН3СОО –
СН3СООН Н+ + СН3СОО – К СН3СООН = [Н+] × [СН3СОО –]
К СН3СООН = [Н+] × [СН3СОО –]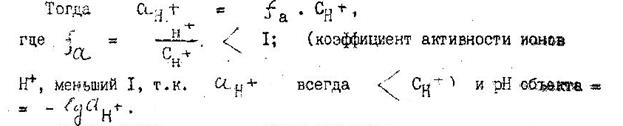
 Данные для построения кривой титрования в координатах Е-V
Данные для построения кривой титрования в координатах Е-V V – объем щелочи (см3)
V – объем щелочи (см3) Е – показания прибора (мВ)
Е – показания прибора (мВ)



