Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Потенциометрический метод анализаСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Потенциометрия основана на измерении электродного потенциала и нахождении зависимости между его величиной и концентрацией (активностью) потенциалопределяющего компонента в растворе. В идеальном случае такая зависимость описывается уравнением Нернста: Еравн= Е0Ox/Red+ где Е0, R, n, F – общеизвестные параметры. Переходя от натуральных логарифмов к десятичным и объединяя все постоянные величины, получим Еравн= Е0Ox/Red+ где Особенностью метода потенциометрии является то, что в процессе измерений электрический ток практически равен нулю, поэтому потенциал почти не отклоняется от равновесного значения. В потенциометрии обычно используют гальванические элементы, включающие два электрода, которые могут быть погружены в один и тот же раствор (элемент без переноса) или в два различных по составу раствора, соединенных солевым мостиком (цепь с переносом). В качестве индикаторных электродов в потенциометрии применяют мембранные (ионоселективные) и металлические электроды. Возникновение потенциала мембранного электрода обусловлено процессами переноса ионов на границе раздела фаз электрод – раствор, потенциал металлического электрода определяется процессами переноса электронов на межфазной границе. Потенциометрические методы делят на прямую потенциометрию (ионометрию) и потенциометрическое титрование. Прямая потенциометрия основана на точном измерении электродного потенциала и нахождении по уравнению Нернста активности (концентрации) потенциалопределяющего иона в растворе. Ионометрия – раздел потенциометрии, в котором в качестве индикаторных электродов используют ионоселективные электроды. Потенциометрическое титрование основано на измерении потенциала индикаторного электрода в процессе химической реакции между определяемым веществом и титрантом. В конечной точке титрования (к.т.т.) одна электрохимическая (индикаторная) реакция меняется на другую, что сопровождается скачком потенциала. Для точного измерения потенциала индикаторного электрода необходимо иметь измерительную аппаратуру, которая либо обеспечивает включение напряжения, соответствующего э.д.с. ячейки (компенсационный метод Погендорфа), либо имеет высокое входное сопротивление. Ячейки с ионоселективными электродами имеют сопротивление порядка 106-108 Ом, поэтому для измерения потенциала в этом случае используют приборы, называемые иономерами или pH-метрами, с входным сопротивлением 109-1012 Ом, превышающим на несколько порядков сопротивление ячеек. Электроды в потенциометрии. Используют два типа электродов: металлические и мембранные. Металлические электроды разделяют на активные и инертные. Активные металлические электроды изготавливают из металлов, способных окисляться (Ag, Pb, Cu, Cd). Потенциал такого электрода является функцией активности собственных ионов (окисленной формы) в растворе. Такие электроды называют электродами I рода. В присутствии анионов, образующих с ионами металла малорастворимое соединение, потенциал электрода зависит от активности (концентрации) аниона. Такие электроды называют электродами II рода. Величина потенциала электрода II рода при достаточно большой площади поверхности и постоянной концентрации аниона хорошо воспроизводится, поэтому эти электроды обычно применяют в качестве электродов сравнения (хлоридсеребряный и каломельный электроды сравнения). Инертные металлические электроды изготавливают из благородных металлов (Pt, Аu, Ir). Они служат переносчиками электронов от восстановленной формы к окисленной, и их потенциалы зависят от соотношения активностей этих форм в растворе. Такие электроды применяют в потенциометрическом окислительно-восстановительном титровании. Мембранные электроды. Мембранные или ионоселективные электроды (ИСЭ) – это сенсоры (чувствительные элементы, датчики), потенциал которых линейно зависит от логарифма активности определяемого иона в растворе. ИСЭ имеют малые размеры, просты в эксплуатации, позволяют непрерывно и в автоматическом режиме проводить измерения; протекающие на них процессы обратимы. Важнейшей частью любого ИСЭ является полупроницаемая мембрана, отделяющая внутренний раствор с постоянной концентрацией определяемого иона от анализируемого раствора. Одновременно мембрана служит средством электролитического контакта между ними. Мембрана обладает ионообменными свойствами, причем проницаемость ее к ионам разного типа различна. В состав мембраны входит соединение, отвечающее за взаимодействие с определяемым ионом – активный компонент мембраны. Способность мембраны быть проницаемой для ионов определенного знака заряда обусловлена наличием ионогенных групп. Если мембрана контактирует с двумя растворами иона А+ с активностями а1 (анализируемый раствор) и а2 (внутренний раствор), то и на внешней и на внутренней сторонах мембраны происходит обмен ионами. Из-за различия активностей ионов А+ в растворе и мембране на обеих сторонах мембраны возникают граничные потенциалы E1 и Е2. С помощью электродов сравнения, помещенных во внешний и внутренний растворы, можно измерить разность E1 и Е2 или так называемый мембранный потенциал Ем: Eм= Е1 - Е2= 0,059 Активность (концентрация) ионов А+ во внутреннем растворе постоянна, поэтому Eм = const + 0,059 lg потенциал мембранного электрода линейно зависит от логарифма активности иона А+ в анализируемом растворе. В более общем случае, если исследуемый раствор содержит два или более ионов (А, В), возможно протекание обменной реакции:
где А+, В+ и
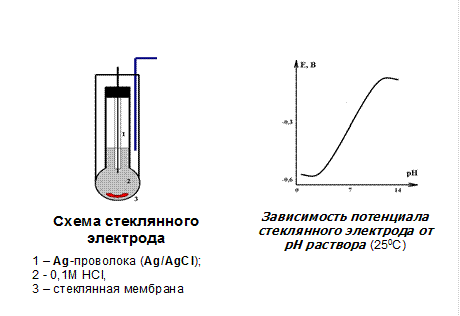
где аА – активность определяемого иона; аВ – активность отдельных посторонних ионов; ZA – заряд определяемого иона; ZB – заряд постороннего иона; KA/B – потенциометрический коэффициент селективности. Основные характеристики ИСЭ – нернстовская область, то есть тот диапазон концентрации, в котором потенциал линейно зависит от lg aA, и селективность, определяемая величиной КА/B. Следует отметить, что нернстовская область составляет для хорошего ИСЭ около 4-5 порядков изменения концентрации, а для стеклянного электрода, который во многом уникален, – более 10 порядков. Это дает возможность определять ионометрически как большие, так и весьма малые содержания ионов. Концентрация, при которой электродная функция перестает зависеть от lg aA, называется пределом обнаружения и определяется экстраполяцией двух прямолинейных участков зависимости Е – lg aA. Существуют несколько классификаций ИСЭ, наиболее наглядная из них – по физическому состоянию активного компонента мембраны. Согласно рекомендациям ИЮПАК, различают: первичные ионоселективные электроды — электроды с кристаллическими мембранами, электроды с жесткой матрицей (стеклянные); электроды с подвижными носителями — положительно заряженными, отрицательно заряженными, незаряженными (с «нейтральными переносчиками»); сенсибилизированные (активированные) электроды — газочувствительные, ферментные. В качестве примера на рис. 2 приведен один из наиболее распространенных ИСЭ – стеклянный. Стеклянные мембраны изготавливают из специальных стекол, подбирая их состав так, чтобы мембрана проявляла повышенную селективность к определенному иону и позволяла определять его в присутствии других. В зависимости от целевого назначения стеклянный электрод может иметь разную форму и размер (от крошечных стерженьков для введения в полость зуба или даже в отдельную клетку до шарика диаметром 10—15 мм для лабораторных аналитических работ). В любом случае главной частью электрода является тонкая рН-чувствительная мембрана. Обычно ее изготавливают из стекла, содержащего 22% оксида натрия, 6% оксида кальция и 72% оксида кремния. Внутренним раствором служит 0,1 М раствор HCl, насыщенный хлоридом серебра. Чувствительностью к ионам водорода обладает только хорошо вымоченная стеклянная мембрана. Современный стеклянный электрод для измерения рН является высокоселективным сенсором (КH/M» 10-15). Выпускают стеклянные электроды с Na+-, K+-, NH4+-, Ag+-функциями.
По значению измеренного потенциала ИСЭ, опущенного в исследуемый раствор, можно определить в нем концентрацию иона металла, пользуясь тремя практическими приемами: методом градуировки электрода, методом градуировочного графика и методом добавок. Самый быстрый и простой из них – метод градуировки электрода. При построении градуировочного графика во все стандартные и анализируемые растворы вводят одинаковый избыток индифферентного электролита. Оптимальным, особенно в случае анализа растворов сложного состава, является метод добавок, основанный на измерении потенциалов электрода в анализируемом растворе и после введения известного объема стандартного раствора. Потенциометрическое титрование. При потенциометрическом титровании необходимо иметь в исследуемом растворе два электрода. Один из них – индикаторный – фиксирует концентрацию титруемого иона. Другой электрод, индифферентный по отношению к титруемым ионам, служит для определения потенциала индикаторного электрода – электрод сравнения. Метод основан на фиксировании изменения равновесного потенциала в зависимости от объема добавленного титранта в процессе титрования. Для титрования пригодны окислительно-восстановительные, кислотно-основные реакции, а также реакции комплексообразования и осаждения. Метод потенциометрического титрования применяют для определения в различных объектах хлорид-, йодид-, бромид-, тиоцианат-, арсенат-, цианид-, ферроцианид-, оксалат-, нитрит-, арсенит-, йодат-ионов и др., а также катионов многих металлов (меди, кадмия, ртути, цинка, висмута, свинца, железа и др.).
|
||||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 1181; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 52.15.113.71 (0.007 с.) |

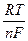 ln
ln  ,
,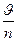 lg
lg  =
=  2.303 = 0.0591 В (при 250 С).
2.303 = 0.0591 В (при 250 С).
 1
1 

 - ионы в водном растворе и фазе мембраны соответственно, КВ,А – константа равновесия реакции ионного обмена. При этом в уравнение (1) вводят дополнительный член, учитывающий влияние мешающих ионов:
- ионы в водном растворе и фазе мембраны соответственно, КВ,А – константа равновесия реакции ионного обмена. При этом в уравнение (1) вводят дополнительный член, учитывающий влияние мешающих ионов: