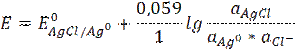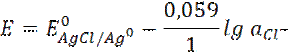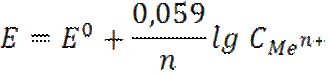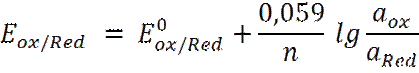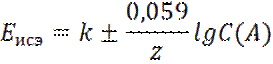Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Электрохимические методы анализаСодержание книги Похожие статьи вашей тематики
Поиск на нашем сайте
ПОТЕНЦИОМЕТРИЯ Потенциометрический метод анализа относится к электрохимическим. Это метод определения концентрации ионов в растворе, основанный на измерении потенциала электрода, погруженного в исследуемый раствор. Потенциал отдельного электрода измерить невозможно. Необходимо составить соответствующую гальваническую ячейку. Она состоит из двух электродов, помещённых в анализируемый раствор. Потенциал одного из этих электродов – индикаторного – зависит от концентрации определяемого иона. Потенциал другого – электрода сравнения постоянен и не зависит от состава анализируемого раствора. В аналитической практике используют две разновидности потенциометрического анализа. Первоая– прямая потенциометрия – измерение потенциала индикаторного электрода и нахождение концентрации определяемого иона по его величине. Вторая – потенциометрическое титрование - измерение потенциала индикаторного электрода в процессе титрования анализируемого раствора.
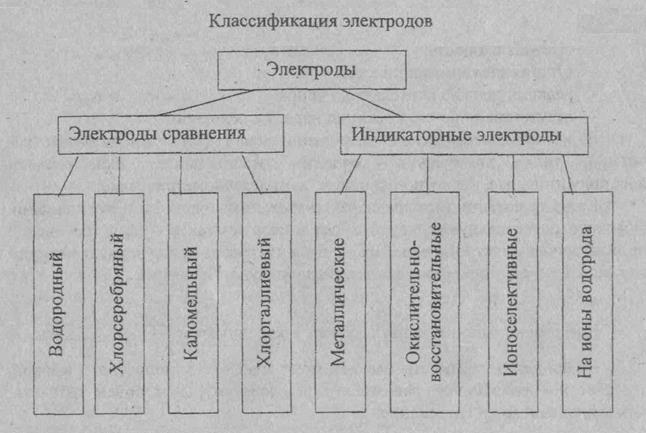
ЭЛЕКТРОДЫ СРАВНЕНИЯ И ИНДИКАТОРНЫЕ ЭЛЕКТРОДЫ Слайд 1
Электроды сравнения Потенциал индикаторного электрода измеряют по отношению к электроду, потенциал которого сохраняется постоянным. Нормальный водородный электрод для практического использования не удобен. Поэтому в качестве электрода сравнения используют специально изготовляемые электроды, потенциалы которых остаются постоянными как при работе с ними, так и при их хранении. Наибольшее применение имеет хлорсеребряный электрод, изготовленный из серебряной проволоки, покрытой тонким слоем хлорида серебра, помещённый в раствор хлорида калия. Также используют каломельный электрод сравнения, содержащий металлическую ртуть, каломель (Hg2CI2) и хлорид калия. Это электроды второго рода. Потенциал электродов второго рода зависит от концентрации анионов.
Слайд 2 Хлорсеребряный электрод Ag | AgCl | KCl Каломельный электрод Hg | Hg2Cl2 | KCl Электрохимическая реакция – реакция на электроде AgCl + e → Ag0 + Cl- Потенциал хлорсеребряного электрода равен Слайд 3
aAgCl = 1 aAg = 1
Если такой электрод опустить в насыщенный раствор хлорида калия, то концентрация хлорид ионов будет постоянная и потенциал хлорсеребряного электрода будет постоянным, т.е. удовлетворять требованию электродов сравнения.
Индикаторные электроды. Индикаторный электрод - электрод, потенциал которого зависит от концентрации определяемых ионов в растворе.
Требования к индикаторным электродам. 1). Должны быть обратимы по отношению к одному из ионов, участвующих в химической реакции. 2). Не должен взаимодействовать с ионами, находящимися в растворе, т.е. должен быть индифферентным. 3). Должен концентрационно правильно и мгновенно реагировать на изменение концентрации потенциалопределяющего иона.
В качестве индикаторных электродов в потенциометрическом методе анализе используется металлические и мембранные ионоселективные электроды (ИСЭ). Металлические электроды. Это электроды первого рода. Они представляют металлический электрод, опущенный в раствор собственной соли. Например, серебряный электрод, это серебряная проволока, опущенная в раствор собственной соли (AgNO3), содержащей ионы серебра.
Слайд4 Реакция в растворе Ag+ + Cl- → AgCl Электрохимическая реакция на электроде Ag+ + e → Ag0↓ E = E0 + 0,059 lg C (Ag+) Таким образом, потенциал серебряного электрода зависит от природы металла (EoAg+/Ag) и концентрации ионов серебра Ag+ в растворе, т.е. является индикаторным электродом для ионов серебра. Серебряный электрод можно применять для определения ионов серебра. Для определения ионов ртути (I) нужен ртутный электрод. В общем виде потенциал электрода первого рода равен
Таким образом, потенциал металлического электрода зависит от концентрации потенциалопределяемых ионов в растворе.
Слайд5 Индикаторные электроды из благородных металлов (платина, золото, палладия) являются индикаторными для окислительно-восстановительных систем. Их потенциал выражается уравнением Нернста
В этом случае металлы являются лишь переносчиками электронов от восстановленной формы к окисленной. Их потенциалы зависят от соотношения концентраций окисленной и восстановленной форм системы. Электроды из платины (и золота) используют при потенциометрическом окислительно – восстановительном титровании.
Ионоселективные мембранные электроды. Ионоселективным называется электрод на основе мембраны, потенциал которой линейно зависит от десятичного логарифма концентрации определяемого иона в растворе. Основной частью такого электрода является полупроницаемая мембрана – тонкая плёнка растворов электролитов, твёрдый или стекловидный электролит. При соприкосновении поверхности с раствором происходит обмен ионами между мембраной и раствором. Таким образом, если возникновение потенциала на металлических электродах связано с переносом электронов через границу раздела электрод – раствор, то в случае мембранных электродов – с обменом ионами между материалом мембраны и раствором.
Слайд 6 Потенциал ионоселективного электрода
где k – постоянная, зависящая от конструкции электрода: знак ± зависит от заряда иона (плюс – для катионов, минус – для анионов); z – заряд иона; С(А) – концентрация иона.
В зависимости от материала мембранные электроды подразделяются на стеклянные, с твёрдой, с жидкой мембранами. Стеклянный электрод – это один из давно известных мембранных электродов, широко используемых для определения pH, т.е. концентрации ионов водорода.
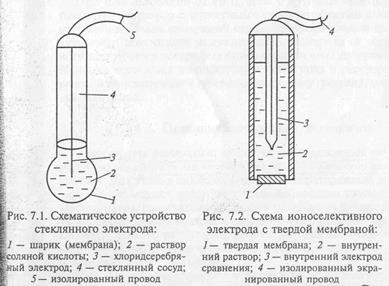
Слайд 7 (стеклянный электрод)
Этот электрод представляет небольшой стеклянный сосуд, к нижней части которого припаян шарик из стекла специального состава. В сосуд заливают 0,1 М раствор соляной кислоты. В этот внутренний раствор погружён хлорсеребряный электрод – серебряная проволока, покрытая хлоридом серебра. К серебряной проволоке припаян изолированный экранированный провод. Стеклянный электрод обычно используют при измерениях pH с хлорсеребряным электродом сравнения. Стеклянный шарик изготовлен из специального стекла, содержащий оксиды: натрия, кальция, лития, кремния. При опускании стеклянного электрода в раствор, содержаний ионы водорода, идёт обменная реакция.
Слайд 8. Na+стекло + H+р-р→ H+стекло + Na+р-р E = k – 0,059pH где k = const зависит от сорта стекла и устройства электрода
Концентрация во внешней и внутренней частях мембраны разная. Поэтому на границе раздела стекло – исследуемый раствор возникает потенциал, который зависит от концентрации ионов водорода в исследуемом растворе, т.е. от pH.
Преимущества стеклянного электрода 1). На измерение pH не влияют посторонние ионы. 2). Потенциал устанавливается быстро. 3). Не отравляется. 4). Пригоден для измерения в широком диапазоне pH: от 1 до 14.
Недостатки. 1). Хрупкость стеклянного шарика.
ЭЛЕКТРОДЫ С ТВЁРДЫМИ МЕМБРАНАМИ В них используют тонкие пластины (мембраны) из веществ, мало растворимых и проводящих ток за счёт ионов. Например, фтор селективный электрод с мембраной из кристаллического три фторида лантана. Этим электродом можно измерять вторичную концентрацию фторид-ионов от 1 до 10-6 моль/л.
ЭЛЕКТРОДЫ С ЖИДКИМИ МЕМБРАНАМИ
В них используют мембрану в виде пористой полимерной плёнки, пропитанной раствором электропроводного вещества в органическом растворителе. Один из ионов электродного вещества обменивается с ионом, находящимся в водном растворе. Такие электроды используются для определения нитрат ионов, хлорид-ионов, бромит-ионов, иодит-ионов, катионов калия, натрия, кальция и др.
|
||||
|
Последнее изменение этой страницы: 2016-08-16; просмотров: 2852; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.190.176.176 (0.009 с.) |