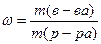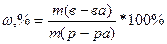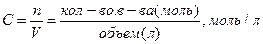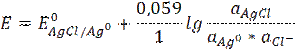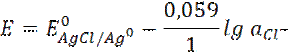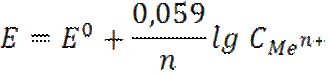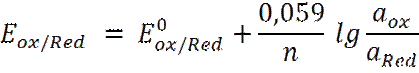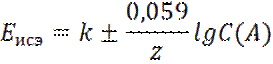Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Методические указания, разработанные на кафедре и изданные в ризо бгу.Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Основная
Основы аналитической химии. /Под ред. Ю.А. Золотова. М.: Высш.шк. 2004. Т.I-II. Основы аналитической химии. Задачи и вопросы. /Под ред. Ю.А. Золотова. М.: Высш.шк. 2002. Основы аналитической химии. Практическое руководство. /Под ред. Ю.А. Золотова. М.: Высш.шк. 2001. Коренман Я.И., Суханов П.Т., Калинкина С.П. Задачник по аналитической химии. Титриметрические методы анализа. Воронеж. 2001 Харитонов Ю.А. Аналитическая химия, ч.1 и 2. М.: Высшая школа, 2003. 6. ОттоМ. Современные методы аналитической химии. Пер. с нем. Под ред. А.В. Гармаша. М.: Техносфера. Т.1. 2003, 412 с. Т.2. 2004. 261 с. 7, Аналитическая химия./ Под ред. А. А. Ищенко. М.: Изд. центр «Академия», 2006
Дополнительная 8. Пятницкий И.В., Пилипенко А.Т. Аналитическая химия. М.: Химия. 1990. ч.1,2. 9. Дорохова Е.Н., Васильев В.П. Аналитическая химия. М.: Высш.шк. 1989 в 2-х ч. 10. Васильев В.П. Аналитическая химия. М.: Высшая школа. 1989. в 2-х частях. 11. Прохорова Г.В. Задачи и вопросы по аналитической химии. М.: Изд-во Моск. ун- та, 1984. 12. Алексеев В.Н. Количественный анализ. М.: Химия, 1972 13. Алексеев В.Н. Курс качественного химического полумикроанализа. М.: Химия. 1973. 14. Ушакова Н. Н,, Николаева Е. Р., Моросанова С. А. Пособие по аналитической химии. Качественный анализ, М.: Изд-во Моск ун-та. 1981. 15. Ушакова Н. Н,, Николаева Е. Р., Моросанова С. А. Пособие по аналитической химии. Количественный анализ, М.: Изд-во Моск ун-та. 1978. 16. Дёрффель К. Статистика в аналитической химии. М.: Мир, 1994. 17. Лурье Ю. Ю. Справочник по аналитической химии. М.: Химия, 1989. 18. Хаханина Т,И. Аналитическая химия: учебное пособие/Т.И. Хаханина, Н.Г. Никитина. М.: Высшее образование, 2009.
Методические указания, разработанные на кафедре и изданные в РИЗО БГУ. Методические указания по использованию Международной системы единиц СИ при решении задач в курсе аналитической химии по способам вычисления концентрации растворов,1998. Титриметрические методы анализа природных, производственных образцов и объектов окружающей среды. Методическое указание, описание лабораторных работ с видеоприложением, 2006. Расчеты в титриметрическом анализе, 2003. Фотоколориметрия. Кафедра аналитической химии БГУ, 2007. Методическое указание к практикуму по аналитической химии, 1989. Гравиметрия. Методическое указание к практикуму по аналитической химии, 1985. Методические указания к самостоятельной работе по решению задач в гравиметрии, 1991. Сборник решений задач и упражнений по титриметрии и гравиметрии, 1991. Методические указания по обработке результатов аналитических определений методами математической статистики, 1985. Справочное пособие по аналитической химии, 2001. Методические указания к самостоятельной работе по аналитической химии для студентов дневного и заочного отделений биологического факультета, 1995. Обнаружение и разделение элементов, 1989. Методические указания к самостоятельной работе для студентов биологического факультета дневного и вечернего отделений при подготовке к рубежному контролю знаний по аналитической химии..Уфа. РИЦ БашГУ. 2012. Методические указания к решению задач по химическим и физико-химическим методам анализа. Тестовые задания. (для студентов биологического факультета дневного и вечернего отделений). Уфа. РИЦ БашГУ. 2012.
Вопросы по аналитической химии для подготовки к экзамену студентам биологического факультета.
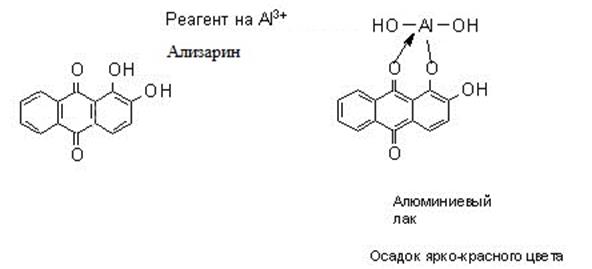
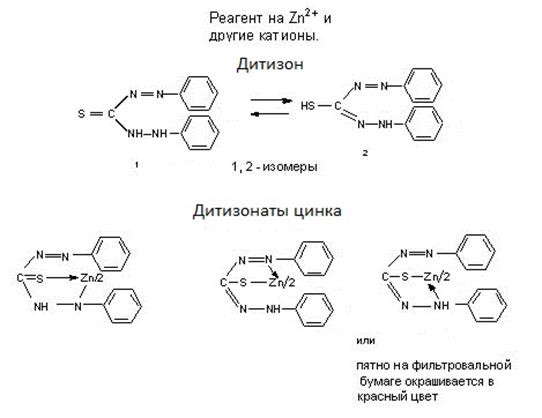
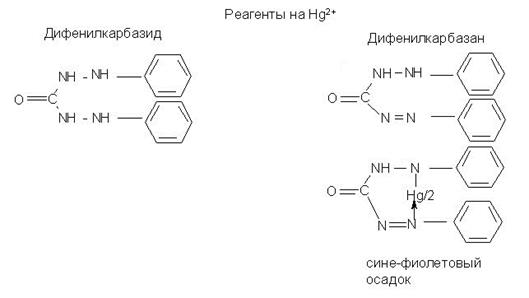
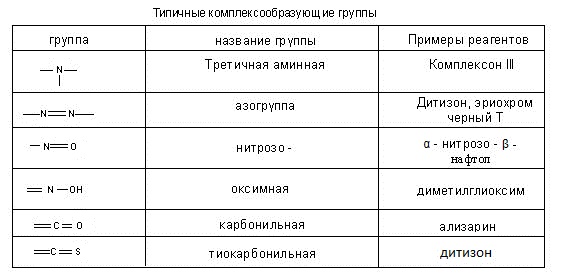
1. Идеальные и реальные системы. Электростатическое взаимодействие между ионами в растворах. Количественные характеристики: активность, коэффициент активности, ионная сила раствора. 2. Термодинамическая и реальная константы равновесия. Связь между ними. Роль в анализе. 3. Реакции комплексообразования в аналитической химии. Устойчивость комплексных соединений. Применение для разделения и определения ионов. Примеры.. 4. Хелаты: свойства, устойчивость. Применение для обнаружения, разделения и определения ионов. Примеры. 5. Равновесный, стандартный потенциалы и их значение в анализе. Примеры. 6. Влияние различных факторов на величину потенциалов и направление окислительно-восстановительных реакций. Примеры использования в анализе. 7. Классификация погрешностей анализа. 8. Правильность и воспроизводимость. 9. Статистическая обработка результатов анализа. 10. Избирательность и чувствительность методов анализа (определения). 11. Способы титриметрических определений. Примеры определений. 12. Перманганатометрическое титрование. Фиксирование точки эквивалентности. 13. Бихроматометрическое титрование. Фиксирование точки эквивалентности. 14. Определение окислителей и восстановителей методом йодометрии. Фиксирование точки эквивалентности. 15. Комплексонометрия. Индикаторы метода. Требования, предъявляемые к ним. Техника комплексонометрического титрования: прямое, обратное, косвенное, титрование заместителя, вытеснительное титрование. Примеры определений. 16. Осадительное титрование. Методы определения точки эквивалентности (метод Мора, Фольгарда, Фаянса (с адсорбционными индикаторами)). 17. Гравиметрический анализ. Осаждаемая и гравиметрическая формы. Требования к ним. 18. Условия осаждения кристаллических и аморфных осадков на примере сульфата бария и гидроксида железа. 19. Методы разделения. Экстракция (коэффициент распределения).. Распределительная хроматография. 20. Фотоколориметрия. Закон Бугера-Ламберта-Бера. Метод градуировочного графика и метод добавок. 21. Потенциометрия. Электроды сравнения и индикаторные электроды. Требования к ним. Выражения потенциалов для этих электродов. 22. Потенциометрическое титрование. Нахождение конечной точки титрования. 23. Качественный и количественный анализ методом пламенно-эмиссионной спектроскопии. Пламя как источник возбуждения атомных спектров. Процессы в пламени. количественный анализ. метод градуировочного графика и метод стандартных добавок. 24. Атомно-абсорбционный анализ. Атомизаторы. Источники излучения. Примеры применения. 25. Кулонометрический метод. Закон Фарадея. Способы измерения количества электричества. Методы определения конечной точки титрования. 26. Полярография. Вид полярографической кривой. Качественный и количественный анализ. Электроды, используемые в полярографии. 27. Амперометрическое титрование. Формы кривых амперометрического титрования. Электроды, используемые в амперометрическом титровании. 28. Классификация хроматографических методов. Ионообменная хроматография. Рапределительная хроматография.
Лекция Буферные растворы Буферные растворы – растворы, которые поддерживают практически постояным рН раствора при добавлении к ним небольших количеств сильных кислот или щелочей, а также при разбавлении. Примеры буферных растворов. Компоненты находятся в соотношении 1:1 НСООН, НСООNa Формиатная буфернвая смесь рН = 3,7 Ацетатная буферная смесь. СН3СООН, СН3СООNа рН= 4,7 Фосфaтная буферная смесь NaH2PO4, Na2HPO4 pH = 6,8 Аммонийная буферная смесь NH4OH, NH4CI pH = 9,3 Индивидуальные вещества Бура: Na2B4O7 10H2O Концентрированные растворы кислот и щелочей. В организме человека присутствуют: гидрокарбонатная, фосфатная, аминокислотная, белковая буферные растворы. Гидрокарбонатная: H2CO3; NaHCO3 рН = 7,4 Мощная буферная система крови. Длительное смешение рН даже на десятые доли приводит к смерти. Фосфатная буферная смесь – основа буферной системы тканей и некоторых биологических жидкостей. Белковая буферная смесь. R-COOH R-COONa Белки плазмы, гемоглобин, оксигемоглобин Нв НвО2 КНв КНвО2
Лекция Иодометрическое титрование I2 + 2Na2S2O3 = Na2S4O6 + 2NaI I2+ 2e → 2I- 1 2S2O3 2- - 2e → S4O6-2 1 Э(I2) = f= M ( Na2S2O3 ∙ 5H2O Э тиосульфата = 1/1 Na2 S2O3 ∙ 5Н2O f = 1/1 M ( Массовая доля
Процентная концентрация
Молярная концентрация
Подготовка к второму занятию.
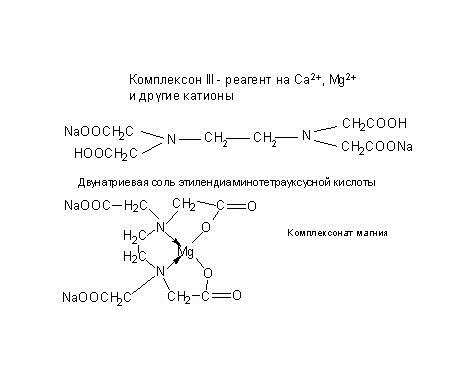
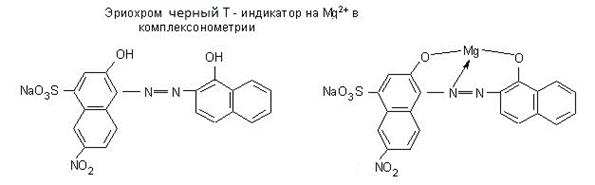
Оформить лабораторную работу. Комплексонометрическое титрование по методическому указанию «Титриметрические методы анализа природных, производственных образцов и объектов окружающей среды». Стр. 40-46. Списать всю работу не сокращая. На защите лабораторной работе уметь писать все формулы в структурном виде (комплексон III, комплексонат магния, эриохром чёрный Т, эриохром чёрный Т с магнием). 2). Подготовка к контрольному тестированию по теме:»Титриметрия». Использовать лекции, печатный раздаточный материал, указанную литературу, методическое указание «Титриметрические методы анализа природных, производственных образцов и объектов окружающей среды», 2006 г.
Подготовка к третьему занятию. 1). Оформить лабораторную работу по методическому указанию «Титриметрические методы анализа природных, производственных образцов и объектов окружающей среды», 2006 г. Йодометрия. Йодометрическое определение меди в мельхиоре, в латуне, в бронзе. Стр. 28-31. (Знать химизм, т.е.уметь писать химические реакции). 2). Подготовка к контрольной работе по решению задач в титриметрии. Воспользоваться методическим указанием «Аналитическая химия». Методические указания к решению задач по химическим и физико-химическим методам анализа. Тестовые задачи.». Стр 4-6 (формулы, по которым нужно вести расчёты в аналитической химии), стр 6-11 (прорешать примеры). Можно потренироваться на тестированных задачах, стр.20-23. Обязательно решить задачи (печатный раздаточный материал. Задачи по приготовлению растворов в титриметрии и расчёт результатов анализа. Задачи у старосты).
Подготовка к четвёртому занятию. 1). Оформить лабораторную работу. Фотоколориметрия. Определение концентрации перманганата калия (печатный раздаточный материал у старосты, одна страница). 2). Контрольное тестирование по теме «Инструментальные методы анализа». 3). Решить задачи по инструментальным методам анализа. (электронный вариант). 4). Принести ноутбуки, если есть, или миллиметровую бумагу, линейку, карандаш, ножницы.
Лекция 8 Способ атомизации.
В ААС аналитический сигнал получают от невозбуждённых атомов, поэтому для атомизации подходят лишь такие источники, энергии которых хватает для распада вещества на атомы, но не для возбуждения атомов. Такими атомизаторами являются пламя и электротермический атомизатор-графитовая кювета, которую нагревают с помощью электрического тока. Анализируемый раствор с помощью распылителя переводится в аэрозоль и подаётся в пламя горелки. Под действием высокой температуры растворитель испаряется, а находящиеся в растворе соли распадаются на атомы, способные поглощать излучение. Источником излучения является лампа с полым катодом. Лампа с полым катодом представляет собой стеклянный или кварцевый баллон, заполненный инертным газом, внутри которого находятся два электрода-катода и анод. Катод изготавливается из того же металла, который нужно определять. При подаче напряжения на электроды возникает тлеющий разряд с образованием положительных ионов газа- наполнителя, например аргона. Положительные ионы бомбардируют катод, выбивая атомы металла в газовую фазу. Там эти атомы возбуждаются и испускают излучение. Излучение направляют на пламя (или графитовую кювету), где находятся атомы определяемого элемента. Таким образом, для определения каждого элемента нужна своя лампа. Приёмником света, прошедшего через пробу, является фотоэлемент или фотоумножитель.
Способы определения концентрации
Поглощение излучения атомами подчиняется тем же законам, что и поглощение молекулами. Сигнал прямо пропорционален концентрации определяемого компонента. Для определения концентрации используют метод градуировочного графика и метод добавок.
Достоинства метода.
- Высокая чувствительность, до 10-3 мкг/мл. - Высокая избирательность. - Экспрессность, т.е. быстрота анализа.
Методом ААС можно определять около 70 элементов в периодической системе Менделеева. Этот метод успешно применяется для определения цинка, железа, марганца и некоторых других элементов в почвах, удобрениях, растениях, водах и т.д. Используется также в клинических и биологических анализах.
Недостатки метода.
- Для определения каждого элемента нужна своя лампа. - Определение только одного элемента в пробе.
Полярография
Полярографический метод анализа основан на снятии поляризационных кривых и дальнейшей расшифровки вольтамперной кривой для целей анализа. В прямой полярографии снимается полярографическая кривая, показыавющая изменение силы тока от потенциала рабочего электрода, то есть снимается практически процесс электролиза. Однако схему, используемую для электролиза, составляют так, чтобы поляризовался только один электрод. Для этого его поверхность делают намного меньше, чем поверхность второго электрода (примерно в 1000 раз). В результате при прохождении тока микроэлектрод будет поляризоваться, а электрод с большой поверхностью поляризоваться не будет, то есть его потенциал практически будет оставаться постоянным и его можно использовать как электрод сравнения. Напряжение Е, подаваемое на электроды, равно:
Е =(φa - φk) + iR, (1)
где φa и φk - потенциалы анода и катода соответственно. Анод не поляризуется, его потенциал равен нулю, тогда
Е = - φk + iR, (2)
При величине тока 10-6-10-8А и сопротивлении раствора, не превышающем 10 000 Ом, падение напряжения в электролите (iR) можно пренебречь и тогда
Е = - φk (3)
Следовательно, если обеспечить высокую электропроводность раствора, напряжение, подаваемое на ячейку, численно равно потенциалу рабочего электрода – катода, и при получении полярографической прямой можно на оси абсцисс откладывать величину подаваемого на электроды напряжения. В качестве рабочего электрода используют ртутный капающий электрод.
Амперометрия Амперометрическим называют такое титрование, которое сопровождается измерением предельного диффузионного тока. Из уравнения Ильковича следует, что предельный ток при разрядке данного иона пропорционален его концентрации в растворе. Значит, если в процессе титрования определяемый ион связывается, например, в труднорастворимое соединение и его концентрация в растворе уменьшается, предельный ток также будет уменьшаться, т.е. предельный диффузионный ток является индикатором титриметрической реакции, а электрод, который фиксирует эти изменения, называется индикаторным. Рассмотрим характер амперометрического титрования на примере определения концентрации ионов свинца в растворе. Если к раствору Pb(NO3)2 постепенно добавлять K2SO4, то ион свинца будет связываться в труднорастворимую соль
Pb(NO3)2 + K2SO4 → PbSO4↓ + 2KNO3 (5)
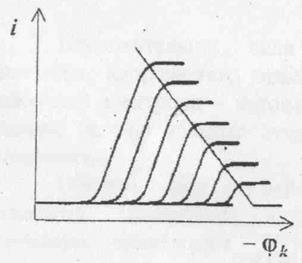
Если после каждой порции осадителя снимать полярограмму, то будут наблюдаться изменения как предельного тока, так и потенциала разряда. Который будет смещаться в отрицательную сторону (рисунок 1).
Рис 1. Изменение полярограммы в процессе титрования.
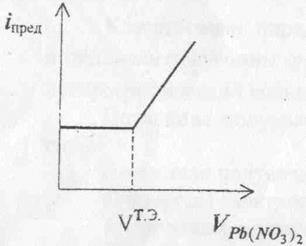
Уменьшение предельного тока будет наблюдаться до тех пор, пока все ионы свинца не свяжутся в осадок, ток при этом будет минимальным. При соединении точек, характеризующих предельный ток, получим линию, отражающего изменение предельного тока в процессе титрования. На практике при амперометрическом титровании в процессе добавления титранта фиксируют изменение предельного тока при постоянном потенциале, соответствующем предельному току. График амперометрического титрования строят в координатах: предельный ток – объём титранта (рисунок 2)
Рис. 2. График амперометрического титрования Pb(NO3)2 раствором K2SO4
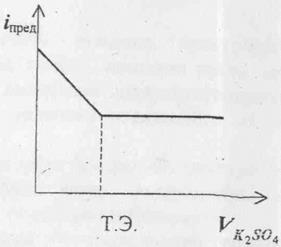
По графику находят объём израсходованного на титрование определяемого компонента и рассчитывают концентрацию анализируемого раствора. Ценность метода амперометрического титрования состоит в том, что он позволяет определять концентрацию электрохимически неактивных веществ. Например, можно определять концентрацию растворов K2SO4, титруя его раствором Pb(NO3)2. В этом случае до точки эквивалентности сила тока меняться не будет, так как ионы не разряжаются на катоде. По мере увеличения избытка ионов свинца ток будет возрастать (Рисунок 3).
Рис.3. График амперометрического титрования K2SO4 раствором Pb(NO3)2
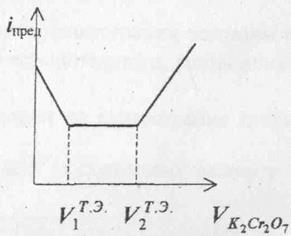
Если в растворе при совместном присутствии находятся два иона, дающие осадки с различным ПР и различающихся по электрохимической активности, то можно использовать график, показанный на рис.4
Рис.4. График амперометрического титрования смеси Pb2+ и Ba2+ бихроматом калия.
Первый участок на графике (рис. 4.) соответствует предельному току свинца. Так как концентрация ионов свинца в процессе титрования уменьшается, ток с увеличением объёма титранта падает до первой токи эквивалентности. Далее в соответствии с ПР титрируется ион бария, однако барий не восстанавливается на катоде при том же потенциале, что и свинец. Поэтому, несмотря на уменьшение концентрации ионов бария при титровании, ток не изменяется. После того, как свяжутся все ионы бария, в растворе появится избыток бихромата, который в данных условиях будет восстанавливаться до CrO42-, сила тока при этом будет возрастать. Таким образом, на кривой появятся два перегиба, первый соответствует моменту эквивалентности при титровании свинца, второй – при титровании бария, Определив по графику объём титранта, можно рассчитать концентрацию каждого иона в растворе. При проведении амперометрического титрования используют реакцию осаждения, комплексообразования, окисления-восстановления.
ПОТЕНЦИОМЕТРИЯ Потенциометрический метод анализа относится к электрохимическим. Это метод определения концентрации ионов в растворе, основанный на измерении потенциала электрода, погруженного в исследуемый раствор. Потенциал отдельного электрода измерить невозможно. Необходимо составить соответствующую гальваническую ячейку. Она состоит из двух электродов, помещённых в анализируемый раствор. Потенциал одного из этих электродов – индикаторного – зависит от концентрации определяемого иона. Потенциал другого – электрода сравнения постоянен и не зависит от состава анализируемого раствора. В аналитической практике используют две разновидности потенциометрического анализа. Первоая– прямая потенциометрия – измерение потенциала индикаторного электрода и нахождение концентрации определяемого иона по его величине. Вторая – потенциометрическое титрование - измерение потенциала индикаторного электрода в процессе титрования анализируемого раствора.
Слайд 1
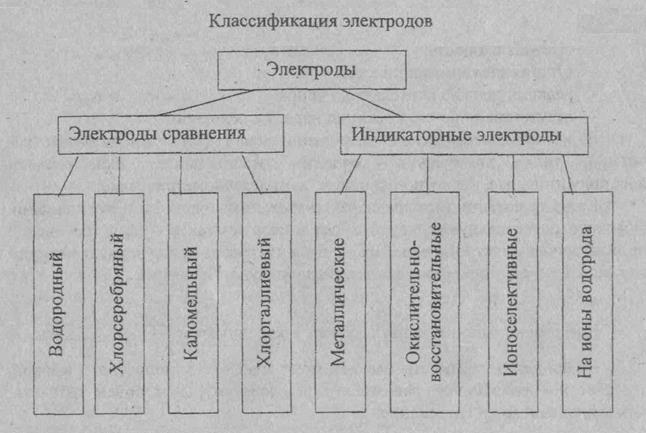
Электроды сравнения Потенциал индикаторного электрода измеряют по отношению к электроду, потенциал которого сохраняется постоянным. Нормальный водородный электрод для практического использования не удобен. Поэтому в качестве электрода сравнения используют специально изготовляемые электроды, потенциалы которых остаются постоянными как при работе с ними, так и при их хранении. Наибольшее применение имеет хлорсеребряный электрод, изготовленный из серебряной проволоки, покрытой тонким слоем хлорида серебра, помещённый в раствор хлорида калия. Также используют каломельный электрод сравнения, содержащий металлическую ртуть, каломель (Hg2CI2) и хлорид калия. Это электроды второго рода. Потенциал электродов второго рода зависит от концентрации анионов.
Слайд 2 Хлорсеребряный электрод Ag | AgCl | KCl Каломельный электрод Hg | Hg2Cl2 | KCl Электрохимическая реакция – реакция на электроде AgCl + e → Ag0 + Cl- Потенциал хлорсеребряного электрода равен Слайд 3
aAgCl = 1 aAg = 1
Если такой электрод опустить в насыщенный раствор хлорида калия, то концентрация хлорид ионов будет постоянная и потенциал хлорсеребряного электрода будет постоянным, т.е. удовлетворять требованию электродов сравнения.
Индикаторные электроды. Индикаторный электрод - электрод, потенциал которого зависит от концентрации определяемых ионов в растворе.
Требования к индикаторным электродам. 1). Должны быть обратимы по отношению к одному из ионов, участвующих в химической реакции. 2). Не должен взаимодействовать с ионами, находящимися в растворе, т.е. должен быть индифферентным. 3). Должен концентрационно правильно и мгновенно реагировать на изменение концентрации потенциалопределяющего иона.
В качестве индикаторных электродов в потенциометрическом методе анализе используется металлические и мембранные ионоселективные электроды (ИСЭ). Металлические электроды. Это электроды первого рода. Они представляют металлический электрод, опущенный в раствор собственной соли. Например, серебряный электрод, это серебряная проволока, опущенная в раствор собственной соли (AgNO3), содержащей ионы серебра.
Слайд4 Реакция в растворе Ag+ + Cl- → AgCl Электрохимическая реакция на электроде Ag+ + e → Ag0↓ E = E0 + 0,059 lg C (Ag+) Таким образом, потенциал серебряного электрода зависит от природы металла (EoAg+/Ag) и концентрации ионов серебра Ag+ в растворе, т.е. является индикаторным электродом для ионов серебра. Серебряный электрод можно применять для определения ионов серебра. Для определения ионов ртути (I) нужен ртутный электрод. В общем виде потенциал электрода первого рода равен
Таким образом, потенциал металлического электрода зависит от концентрации потенциалопределяемых ионов в растворе.
Слайд5 Индикаторные электроды из благородных металлов (платина, золото, палладия) являются индикаторными для окислительно-восстановительных систем. Их потенциал выражается уравнением Нернста
В этом случае металлы являются лишь переносчиками электронов от восстановленной формы к окисленной. Их потенциалы зависят от соотношения концентраций окисленной и восстановленной форм системы. Электроды из платины (и золота) используют при потенциометрическом окислительно – восстановительном титровании.
Ионоселективные мембранные электроды. Ионоселективным называется электрод на основе мембраны, потенциал которой линейно зависит от десятичного логарифма концентрации определяемого иона в растворе. Основной частью такого электрода является полупроницаемая мембрана – тонкая плёнка растворов электролитов, твёрдый или стекловидный электролит. При соприкосновении поверхности с раствором происходит обмен ионами между мембраной и раствором. Таким образом, если возникновение потенциала на металлических электродах связано с переносом электронов через границу раздела электрод – раствор, то в случае мембранных электродов – с обменом ионами между материалом мембраны и раствором.
Слайд 6 Потенциал ионоселективного электрода
где k – постоянная, зависящая от конструкции электрода: знак ± зависит от заряда иона (плюс – для катионов, минус – для анионов); z – заряд иона; С(А) – концентрация иона.
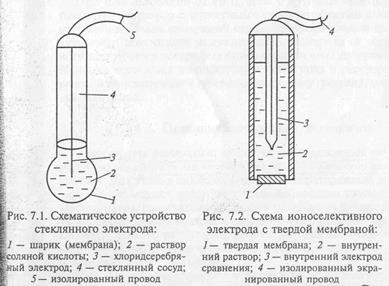
В зависимости от материала мембранные электроды подразделяются на стеклянные, с твёрдой, с жидкой мембранами. Стеклянный электрод – это один из давно известных мембранных электродов, широко используемых для определения pH, т.е. концентрации ионов водорода.
Слайд 7 (стеклянный электрод)
Этот электрод представляет небольшой стеклянный сосуд, к нижней части которого припаян шарик из стекла специального состава. В сосуд заливают 0,1 М раствор соляной кислоты. В этот внутренний раствор погружён хлорсеребряный электрод – серебряная проволока, покрытая хлоридом серебра. К серебряной проволоке припаян изолированный экранированный провод. Стеклянный электрод обычно используют при измерениях pH с хлорсеребряным электродом сравнения. Стеклянный шарик изготовлен из специального стекла, содержащий оксиды: натрия, кальция, лития, кремния. При опускании стеклянного электрода в раствор, содержаний ионы водорода, идёт обменная реакция.
Слайд 8. Na+стекло + H+р-р→ H+стекло + Na+р-р E = k – 0,059pH где k = const зависит от сорта стекла и устройства электрода
Концентрация во внешней и внутренней частях мембраны разная. Поэтому на границе раздела стекло – исследуемый раствор возникает потенциал, который зависит от концентрации ионов водорода в исследуемом растворе, т.е. от pH.
Преимущества стеклянного электрода 1). На измерение pH не влияют посторонние ионы. 2). Потенциал устанавливается быстро. 3). Не отравляется. 4). Пригоден для измерения в широком диапазоне pH: от 1 до 14.
Недостатки. 1). Хрупкость стеклянного шарика.
ЭЛЕКТРОДЫ С ТВЁРДЫМИ МЕМБРАНАМИ В них используют тонкие пластины (мембраны) из веществ, мало растворимых и проводящих ток за счёт ионов. Например, фтор селективный электрод с мембраной из кристаллического три фторида лантана. Этим электродом можно измерять вторичную концентрацию фторид-ионов от 1 до 10-6 моль/л.
ЭЛЕКТРОДЫ С ЖИДКИМИ МЕМБРАНАМИ
В них используют мембрану в виде пористой полимерной плёнки, пропитанной раствором электропроводного вещества в органическом растворителе. Один из ионов электродного вещества обменивается с ионом, находящимся в водном растворе. Такие электроды используются для определения нитрат ионов, хлорид-ионов, бромит-ионов, иодит-ионов, катионов калия, натрия, кальция и др.
Ионометрия, рН-метрия Способ определения концентрации ионов по измерению потенциала ионоселективного мембранного электрода называют ионометрией. Приборы для прямой потенциометрии называют иономерами. Наиболее широкое применение нашла прямая потенциометрии для определения рН растворов с использованием стеклянного электрода. Потенциал стеклянного электрода описывается уравнением
E = k – 0,059 рН
В качестве электрода сравнения используется хлорсеребряный электрод. Электроды помещают в анализируемый раствор и измеряют рН этого раствора с помощью прибора рН-метра. При использовании других ионоселективных электродов готовят ряд растворов с известными концентрациями анализируемых ионов. Строят градуироваочный график зависимости потенциала индикатороного электрода от отрицательного десятичного логарифма к концентрации анализируемого иона. Измерив потенциал индикаторного электрода в растворе с неизвестной концентрацией, по градуировочному нрафику находят его концентрацию.
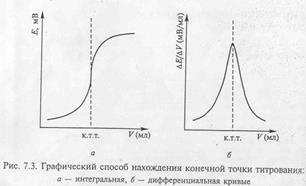
Слайд 9
Другой способ состоит в построении дифференциальной кривой: на оси ординат откладывают отношение ∆ E/∆V, а на оси абсцисс – объём прибавленного титранта V. Максимум на кривой титрования соответствует объёму титранта в конечной точке титрования. Принципы метода. Кулонометрический анализ (кулонометрия) основан на использовании зависимости между массой m вещества, прореагировавшего при электролизе в электрохимической ячейке, и количеством электричества Q, прошедшего через электрохимическую ячейку при электролизе только этого вещества. В соответствии с объединённым законом электролиза Фарадея масса m (в граммах) связана с количеством электричества Q (в кулонах) соотношением
m = QM/nF, (1) где M – молярная масса вещества, прореагировавшего при электролизе, г/моль; n – число электронов, участвующих в электродной реакции; F – 96487 Кл/моль – число фарадея. Количество электричества Q (в Кл), прошедшее при электролизе через электрохимическую ячейку, равно произведению электрического тока i (в А) на время электролиза τ (в с);
Q = iτ (2) Если измерено количество электричества Q, то согласно (1)можно рассчитать массу m. Это справедливо в том случае, когда всё количество электричества Q, прошедшее при электролизе через электрохимическую ячейку, израсходовано только на электролиз данного вещества; побочные процессы должны быть исключены, т.е. выход по току должен быть равен 100%. Главная задача кулонометрических измерений – как можно более точно определить количество электричества Q. Кулонометрический анализ проводят либо в гальваностатическом режиме, т.е. при постоянном электрическом токе, либо при контролируемом постоянном потенциале рабочего электрода (потенциостатическая кулонометрия), когда электрический ток уменьшается в процессе электролиза. В первом случае для определения количества электричества Q достаточно как можно более точно измеритьвремя электролиза τ (с), постоянный ток i (А) и рассчитать величину Q по формуле (2). Во втором случае величину Q определеяют либо расчётным способом, либо с помощью химических кулонометров. Различают прямую кулонометрию и косвенную кулонометрию (кулонометрическое титрование).
Прямая кулонометрия
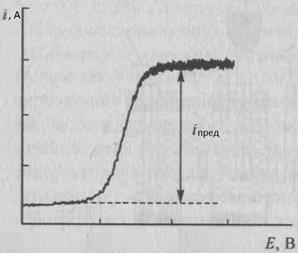
Сущность метода. Прямую кулонометрию при постоянном токе применяют редко. Чаще используют кулонометрию при контролируемом постоянном потенциале рабочего электрода или прямую потенциостатическую кулонометрию. В прямой потенциостатичекой кулонометрии электролизу подвергают непосредственно определяемое вещество. Измеряют количество электричества, затраченное на электролиз этого вещества, и по уравнению (1) рассчитывают массу m определяемого вещества. В процессе электролиза потенциал рабочего электрода поддерживают постоянным, E = const, для чего обычно используют приборы – потенциостаты. Постоянное значение потенциала E выбирают предварительно на основании рассмотрения вольт – амперной кривой, построенной в координатах токi – потенциал E, полученной в тех же условиях, в которых будет проводиться электролиз. Обычно выбирают значение потенциала E, соответствующее области предельного тока для определяемого вещества.
Рис1, Харитонов, стр. 468
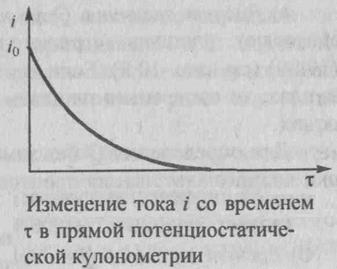
По мере протекания процесса электролиза при постоянном потенциале электрический ток в ячейке уменьшается, так как понижается концентрация электроактивного вещества, участвующего в электродной реакции. При этом электрический ток уменьшается со временем по экспоненциальному закону от начального значения io в момент времени τ = 0 до значения i в момент времени τ
i = io ∙e-kτ, где k= const. (3) График функции (3) схематично показан на рис. 2
Рис.2 изменение тока i со временем τ в прямойпотенциостатической кулонометрии.
Выход по току будет количественным, когда ток i уменьшится до нуля, т.е. при бесконечно большом времени τ. На практике электролиз определяемого вещества считают количественным, когда ток достигает очень малой величины, не превышающей ~0,1% от значения io. Общее количество электричества Q, затраченное на электролиз определяемого вещества, равно
Q = ∫idτ, (4)
т.е. определяется площадью, ограниченной осями координат и экспонентой на рис.2 Для нахождения массы m прореагировавшего вещества требуется согласно (1) измерить или рассчитать количество электричества Q. Способы определения количества электричества, прошедшего через раствор, в прямой потенциостатической кулонометрии. Величину Q можно определить расчётными способами либо с помощью химического кулонометра. а) Расчёт величины Q по площади под кривой зависимости i от τ. Измеряют площадь, ограниченную осями координат и экспонентой (3) (см. рис. 2). Если ток i выражен в амперах, а время τ - в секундах, то измеренная площадь равна количеству электричества Q в кулонах. б) Расчёт величины Q на основе зависимости In i от τ. В соответствии с (3) и (4) имеем:
формула, Харитонов, стр. 484, уравн.11 (5)
Таким образом, Q = io/k и для определения величины Q необходимо найти значения io и k. Согласно (3) i = ioe |
||||
|
Последнее изменение этой страницы: 2016-08-16; просмотров: 572; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.117.231.160 (0.033 с.) |

 I2
I2