
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Кулонометрическое титрованиеСодержание книги Поиск на нашем сайте
Сущность метода. При кулонометрическом титровании определяемое вещество X, находящееся в растворе в электрохимической ячейке, реагирует с «титрантом» Т – веществом, непрерывно образующемся (генерируемом) на генераторном электроде при электролизе вспомогательного вещества, также присутствующего в растворе. Окончание титрования – момент, когда всё определяемое вещество X полностью прореагирует с генерируемым «титрантом» Т фиксируют либо визуально индикаторным методом, вводя в раствор соответствующий индикатор, либо с помощью инструментальных методов – потенциометрически, амперометрически, фотометрически. Таким образом, при кулонометрическом титровании титрант не прибавляется из бюретки в титрируемый раствор. Титрант не готовят и не стандартизируют. Роль титранта играет вещество Т, непрерывно генерируемое при электродной реакции на генераторном электроде. Кулонометрическое титрование проводят при постоянном токе (гальваностатическом режиме) или в потенциостатическом режиме. Чаще кулонометрическое титрование проводят, поддерживая электрический ток постоянным в течение всего времени электролизе. Вместо объёма прибавленного титранта в кулонометрическом титровании измеряют время τ и ток i электролиза. Процесс образования вещества Т в кулонометрической ячейке во время электролиза называется генерация титранта. Кулонометрическое титрование при постоянном токе. При кулонометрическом титровании при постоянном токе измеряют время τ, в течение которого проводится электролиз, затем рассчитывают количество электричества Q, израсходованное при электролизе по формуле (2), после чего находят массу определяемого вещества X по соотношению (1). Индикация конца титрования. При электрохимической индикации ТЭ в испытываемый раствор (в генераторный сосуд) помещают ещё пару электродов, входящих в дополнительную индикаторную электрическую цепь. Окончание титрования можно фиксировать с помощью дополнительной индикаторной электрической цепи потенциометрически (рН-метрически) или амперометрически.
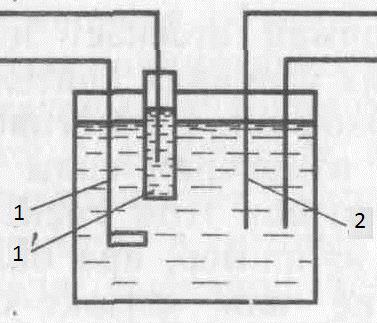
Рис.4. Электролитическая ячейка для кулонометрического титрования с внутренней генерацией титранта. 1 и 1’ – генераторные, 2 – индикаторные электроды.
Когда титрант генерируется в той же ячейке, где находится и определяемое вещество, кулонометрическое титрование называют титрованием с внутренней генерацией. Ячейки ч внешней генерацией титранта, когда титрант генерируется в отдельной камере и затем добовляется к анализируемому веществу, применяются реже, однако иногда они бываю крайне необходимы, например кулонометрическое определение кислот, основанное на генерирование гидроксильных ионов при электролизе воды. Для повышения электропроводности раствора вводят сильный электролит сульфат калия. На катоде происходит восстановлени6е воды
2H2O + 2e = H2 + 2OH-
а на аноде её окисление
2H2O = O2 +4H+ +4e Чтобы не допустить случайного попадания ионов водорода из анодного пространства в рабочий объём применяются ячейки с внешней генерацией гидроксильных ионов.
Типовые тренировочные задачи по теме «Инструментальные методы анализа» для подготовки к рубежному контролю Модуля 2. 1) Вычислить потенциал медного электрода, помещенного в 0,01 моль/л раствор CuSO4, относительно насыщенного хлоридсеребряного электрода. Решение: Медный электрод – электрод I рода. ECu2+/Cu0 = E0Cu2+/Cu0 + Потенциал насыщенного хлоридсеребряного электрода равен 0, 201 В. E = ECu2+/Cu0 – E AgCl/Ag0, Cl - = 0,286 – 0,201 = 0,085 B Ответ: 0,085 В.
Типовые тренировочные задачи по теме «Инструментальные методы анализа» для подготовки к рубежному контролю Модуля 2. 2) Вычислить потенциал платинового электрода (В), помещенного в растворе FeSO4, на 99,9% оттитрованного раствором KMnO4 . Решение: EFe3+/Fe2+ = E0 Fe3+/Fe2+ + 0,059 lg [Fe3+] / [Fe2+] Исходный раствор FeSO4 оттитрован на 99,9 %, поэтому [Fe3+] / [Fe2+] = 99,9 / 0,1 = 103 EFe3+/Fe2+ = 0,771 + 0,059 . 103 = 0,771 + 0,177 = 0,948 B
Типовые тренировочные задачи по теме «Инструментальные методы анализа» для подготовки к рубежному контролю Модуля 2. 3) Потенциал хингидронного электрода относительно 1,0 моль/л стандартного каломельного электрода при 200С равен 0,054 В. Вычислить pH раствора. Решение: Потенциал хингидронного электрода (Ex) определяется по формуле Ex = Ex0 + 0,059 lg [H+] или Ex = Ex0 – 0,059 pH Ex0 = 0,703 B Ex = 0,703 – 0,059 pH Потенциал каломельного электрода Ek = 0,284 B ЭДС определяется E = Ex – Ek = 0,054 B 0,054 = 0,703 – 0,059 pH – 0,284
pH = Ответ: 6,19.
Типовые тренировочные задачи по теме «Инструментальные методы анализа» для подготовки к рубежному контролю Модуля 2. 4) Рассчитать потенциал водородного электрода в 0,1 моль/л растворе HCl. Решение:
EH2/2H+ = E0H2/2H+ +
Типовые тренировочные задачи по теме «Инструментальные методы анализа» для подготовки к рубежному контролю Модуля 2. 11) На амперометрическое титрование 100 мл концентрата из порошка какао, содержащего 8,84 . 10-8 г Ni2+, затрачено 24,4 мл спиртового раствора диметилглиоксима (ДМГ), E = - 1,76 B. Рассчитать молярную концентрацию раствора ДМГ. Выбрать электроды и обосновать вид амперометрической кривой титрования.
Решение: n (Ni2+) = 8,84 . 10-8/ 58,7 = 1,505 . 10-9 моль с (Ni2+) = 1,505 . 10-9/0,1 = 1,505 . 10-8 моль/л c1 . V1 = c2 . V2, 1,505 . 10-8 . 100 = 24,4 . c ДМГ c ДМГ = 6,17 . 10-8 моль/л В качестве индикаторного электрода применяют металлический электрод первого рода, обратимый относительно Ni2+.
V, мл Ni2+ на индикаторном электроде восстанавливается, при этом сила тока уменьшается. После точки эквивалентности на индикаторном электроде восстанавливается избыток ДМГ, сила тока возрастает.
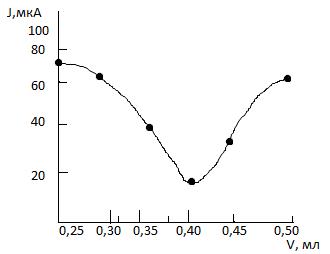
Типовые тренировочные задачи по теме «Инструментальные методы анализа» для подготовки к рубежному контролю Модуля 2. 12) При потенциале ртутного капающего электрода E = - 1,40 В при амперометрическом титровании ацетальдегида 2,4-динитрофенилгидразином с титром T = 5,6 . 10-6 г/мл получили следующие результаты:
Найти точку эквивалентности (V ТЭ,мл) и массу (г) ацетальдегида в растворе. Решение: Строим кривую титрования:
Точка эквивалентности соответствует 0,40 мл m= T . V m= 5,6 . 10-6 . 0,4 = 2,24 . 10-6 г
Типовые тренировочные задачи по теме «Инструментальные методы анализа» для подготовки к рубежному контролю Модуля 2. 13) Марганец – один из важнейших микроэлементов живой природы. При определении марганца в виде перманганата плотность раствора, содержащего 0,12 мг марганца в 100 см3, равна 0,152 (λ = 525 нм, l = 3 см). Найти молярный коэффициент светопоглощения. Решение: n (Mn) = 0,12 . 10-3 / 55 = 2,18 . 10-6 моль c = n / V = 2,18 . 10-6 / 0,1 = 2,18 . 10-5 моль/л ελ = A/ (c . l) = 0,152 / (3 . 2,18 . 10-5) = 2,3 . 103
Типовые тренировочные задачи по теме «Инструментальные методы анализа» для подготовки к рубежному контролю Модуля 2. 14) Молярный коэффициент светопоглощения вещества 1,5 . 104. Вычислить минимальное количество вещества, которое можно определить по фотометрической реакции, проводимой в растворе объемом 25,00 мл. Оптическая плотность А ≥ 0,10 при толщине светопоглощающего слоя l = 3,0 см. Решение: c = A/ ε λ . l = 0,1/ (1,5 . 104 . 3) = 2,22 . 10-6 моль/л c = n/V, n= c . V, n=2,22 . 10-6 . 0,025 = 5,6 . 10-8 моль. Ответ: 5,6 . 10-8 моль.
Типовые тренировочные задачи по теме «Инструментальные методы анализа» для подготовки к рубежному контролю Модуля 2. 15) В вытяжке из сыра методом фотометрии пламени определили содержание Ca2+. Анализ выполнили методом добавок. Сила фототока при фотометрировании анализируемой пробы (х) равна 17,0 мкА. При добавлении к такому же объему пробы стандартного раствора Ca2+ получены следующие данные:
Найти содержание Ca2+ в вытяжке из сыра (мкг/см3). Решение: Строим график 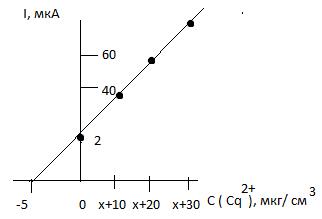
Точка пересечения прямой с осью абсцисс соответствует содержанию определяемого вещества в анализируемом растворе: 5,0 мкг/см3.
Типовые тренировочные задачи по теме «Инструментальные методы анализа» для подготовки к рубежному контролю Модуля 2. 16) Потенциал возбуждения резонансного уровня атома калия 1,6 эВ. Рассчитать длину волны (нм) резонансной линии в атомном спектре калия. Решение:
h= 4,135 . 10-15 эВ/ С с = 3 . 108 м/c = 3 . 1017 нм/с λ = h . c/ ΔE = 4,135 . 10-15 . 3 . 1017/ 1,6 = 775 нм
Типовые тренировочные задачи по теме «Инструментальные методы анализа» для подготовки к рубежному контролю Модуля 2. 17) При фотометрировании стандартных водных растворов соли Na+ на пламенном фотометре получены следующие данные:
При анализе водной пробы сила фототока 45,0 мкА. Найти содержание Na+ в водной пробе (мкг/см3). Решение: Строим график
Cx= 17 мкг/ см3
Типовые тренировочные задачи по теме «Инструментальные методы анализа» для подготовки к рубежному контролю Модуля 2. 18) При определении белка в ячмене оптическая плотность анализируемой пробы равна 0,44 (l = 2,0 см). Оптическая плотность стандартного раствора, содержащего 0,50 мг/см3 белка, составляет 0,60 (l = 3,0 см). Вычислить содержание белка в ячмене (мг/см3). Решение: Определяем εx для стандартного раствора. A = ελ . c . l εx = 0,60/ 3 . 0,50 = 0,4 Зная ελ, определяем Сх Ax = ελ Сх l Сх = 0,44/2 . 0,4 = 0,55 мг/см3
Типовые тренировочные задачи по теме «Инструментальные методы анализа» для подготовки к рубежному контролю Модуля 2. 19) Оптическая плотность водной вытяжки из мяса после проведения биуретовой реакции равна 0,40. Найти светопропускание анализируемой вытяжки (%). Ответ: 39,8 % Решение: A= - lg T; T= 10-A = 10-0,40 = 101 . 100,60 = 0,398 в процентах 39,8 %
Типовые тренировочные задачи по теме «Инструментальные методы анализа» для подготовки к рубежному контролю Модуля 2. 23) Содержащиеся в яблочном соке ионы Fe3+ восстановители до Fe2+. При кулонометрическом титровании анализируемой пробы электрогенерируемыми ионами Sn2+ при постоянной силе тока 5,0 мА в растворе HCl электролиз закончился за 85 с. Вычислить массу (мг) Fe3+ в яблочном соке. Ответ: 0,25 мг Решение: m= i.t.M / n.F = 5 . 10-3 . 85 . 55,85/ 1 . 96500 = 0,25 мг
Типовые тренировочные задачи по теме «Инструментальные методы анализа» для подготовки к рубежному контролю Модуля 2. 24) Для построения градуировочного графика получили вольтамперограммы стандартных растворов Pb2+ и измерили высоту волны:
Для определения Pb2+ в сточной воде отобрали 50,00 мл воды и измерили высоту волны, она составила 11,0 мм. Вычислить молярную концентрацию Pb2+ в сточной воде. Ответ: 6,73 . 10-6 моль/ л Решение: Строим градуированный график
Определяем неизвестную концентрацию СPb2+ = 1,4 . 10-6 г/мл n (Pb2+) = 1,4 . 10-6 /208 = 6,73 . 10-9 моль 1 мл = 10-3 л Следовательно, c (Pb2+) = 6,73 . 10-9/ 10-3 = 6,73 . 10-6 моль/л
Типовые тренировочные задачи по теме «Инструментальные методы анализа» для подготовки к рубежному контролю Модуля 2. 26) Молярный коэффициент светопоглощения раствора моносульфосалицилата Fe3+ ε = 1,6 . 103. Какова должна быть масса (г) Fe3+ в стандартных растворах, приготовленных в мерных колбах вместимостью 100 мл, чтобы оптические плотности растворов находились в интервале 0,1-1,0. Толщина светопоглощающего слоя l = 1,0 см. Решение: C= A/ ε l = 0,1 / (1,6 . 103 . 1)= 6,25 . 10-5 моль/л n= CV= 6,25 . 10-5 . 0,1= 6,25 . 10-6 моль m (Fe3+) = 6,25 . 10-6 . 56 = 3,5 . 10-4 г c = 1,0 / (1,6 . 103. 1) = 6,25 . 10-4 моль/л n= CV= 6,25 . 10-4 . 0,1= 6,25 . 10-5 моль m(Fe3+) = 6,25 . 10-5 . 56 = 3,5 . 10-3 г
Типовые тренировочные задачи по теме «Инструментальные методы анализа» для подготовки к рубежному контролю Модуля 2. 27) Раствор, содержащий Fe3+ в присутствии 0,1 моль/л Sn4+, оттитровали электрогенерируемыми ионами Sn2+ при силе тока 24 мА за 100 с. Вычислить массу Fe3+ в анализируемом растворе. Решение: В ячейке кулонометра протекает полуреакция:
m (Fe3+) = Ответ: 0,0014 г
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-08-16; просмотров: 2553; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.117.11.119 (0.007 с.) |

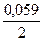 lg [Cu2+] = 0,345 +
lg [Cu2+] = 0,345 + 
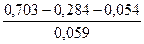 = 6,19
= 6,19 2H+ + 2e H2
2H+ + 2e H2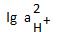 = 0 +
= 0 +  I,mA
I,mA

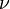 = h . c / λ
= h . c / λ
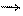 Fe3+ + e Fe2+
Fe3+ + e Fe2+
 Fe2+ - е
Fe2+ - е  Fe3+
Fe3+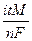 = 24 . 10-3 . 100 . 55,85 / 1 . 96500 = 0,0014 г
= 24 . 10-3 . 100 . 55,85 / 1 . 96500 = 0,0014 г


