Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Качественный полярографический анализСодержание книги Поиск на нашем сайте
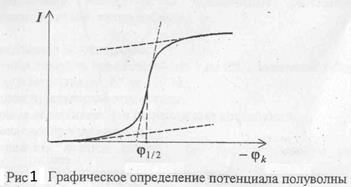
Качественные определения в полярографии основаны на установлении потенциала полуволны φ 1/2, т.е. потенциала, соответствующего середине полярографической волны. Потенциал полуволны находят по полярограмме графически (рисунок 1)
Рисунок 1. Графическое определение потенциала полуволны.
Потенциал полуволны зависит от следующих факторов: а) природы электрода; б) природы разряжающихся ионов; в) природы фона; г) наличие в растворе комплексообразователей; д) температуры.
Количественный полярографический анализ Количественный полярографический анализ основан на зависимости предельного диффузионного тока от концентрации ионов в растворе, которая математически даётся уравнением Ильковича
Id = 605•n•D1/2•m2/3•τ1/6•С, (4)
где Id – предельный диффузионный ток, мкА; 605 – коэффициент, зависящий от плотности ртути, следовательно, от температуры; n – число электронов, участвующих в электродном процессе; D – коэффициент диффузии; m – масса ртутной капли, вытекающей из капилляра; τ – период капания, с; С – концентрация определяемого вещества в растворе. Уравнение Ильковича показывает, что при постоянных условиях эксперимента предельный диффузионный ток пропорционален концентрации деполяризатора. Таким образом, зная все величины, кроме С, и измерив Id, можно определить концентрацию деполяризатора в растворе:
605•n• D1/2•m2/3•τ1/6 = K, (5)
отсюда
Id = К•С (4)
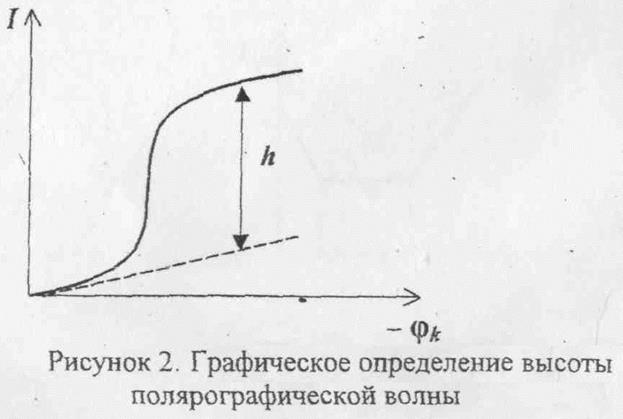
Предельный ток определяет высоту полярографической волны, то есть практически для проведения количественного анализа можно использовать зависимость: h = К • С
Высоту волны определяют графически (рисунок 2)
Амперометрия Амперометрическим называют такое титрование, которое сопровождается измерением предельного диффузионного тока. Из уравнения Ильковича следует, что предельный ток при разрядке данного иона пропорционален его концентрации в растворе. Значит, если в процессе титрования определяемый ион связывается, например, в труднорастворимое соединение и его концентрация в растворе уменьшается, предельный ток также будет уменьшаться, т.е. предельный диффузионный ток является индикатором титриметрической реакции, а электрод, который фиксирует эти изменения, называется индикаторным. Рассмотрим характер амперометрического титрования на примере определения концентрации ионов свинца в растворе. Если к раствору Pb(NO3)2 постепенно добавлять K2SO4, то ион свинца будет связываться в труднорастворимую соль
Pb(NO3)2 + K2SO4 → PbSO4↓ + 2KNO3 (5)
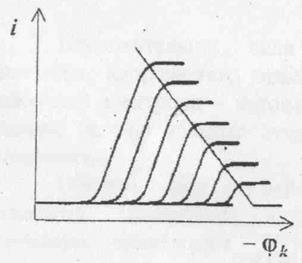
Если после каждой порции осадителя снимать полярограмму, то будут наблюдаться изменения как предельного тока, так и потенциала разряда. Который будет смещаться в отрицательную сторону (рисунок 1).
Рис 1. Изменение полярограммы в процессе титрования.
Уменьшение предельного тока будет наблюдаться до тех пор, пока все ионы свинца не свяжутся в осадок, ток при этом будет минимальным. При соединении точек, характеризующих предельный ток, получим линию, отражающего изменение предельного тока в процессе титрования. На практике при амперометрическом титровании в процессе добавления титранта фиксируют изменение предельного тока при постоянном потенциале, соответствующем предельному току. График амперометрического титрования строят в координатах: предельный ток – объём титранта (рисунок 2)
Рис. 2. График амперометрического титрования Pb(NO3)2 раствором K2SO4
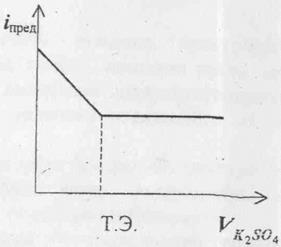
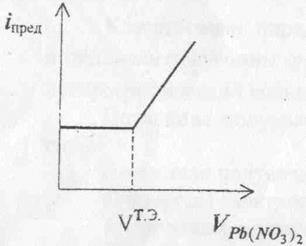
По графику находят объём израсходованного на титрование определяемого компонента и рассчитывают концентрацию анализируемого раствора. Ценность метода амперометрического титрования состоит в том, что он позволяет определять концентрацию электрохимически неактивных веществ. Например, можно определять концентрацию растворов K2SO4, титруя его раствором Pb(NO3)2. В этом случае до точки эквивалентности сила тока меняться не будет, так как ионы не разряжаются на катоде. По мере увеличения избытка ионов свинца ток будет возрастать (Рисунок 3).
Рис.3. График амперометрического титрования K2SO4 раствором Pb(NO3)2
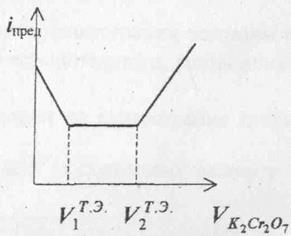
Если в растворе при совместном присутствии находятся два иона, дающие осадки с различным ПР и различающихся по электрохимической активности, то можно использовать график, показанный на рис.4
Рис.4. График амперометрического титрования смеси Pb2+ и Ba2+ бихроматом калия.
Первый участок на графике (рис. 4.) соответствует предельному току свинца. Так как концентрация ионов свинца в процессе титрования уменьшается, ток с увеличением объёма титранта падает до первой токи эквивалентности. Далее в соответствии с ПР титрируется ион бария, однако барий не восстанавливается на катоде при том же потенциале, что и свинец. Поэтому, несмотря на уменьшение концентрации ионов бария при титровании, ток не изменяется. После того, как свяжутся все ионы бария, в растворе появится избыток бихромата, который в данных условиях будет восстанавливаться до CrO42-, сила тока при этом будет возрастать. Таким образом, на кривой появятся два перегиба, первый соответствует моменту эквивалентности при титровании свинца, второй – при титровании бария, Определив по графику объём титранта, можно рассчитать концентрацию каждого иона в растворе. При проведении амперометрического титрования используют реакцию осаждения, комплексообразования, окисления-восстановления.
|
||||
|
Последнее изменение этой страницы: 2016-08-16; просмотров: 2520; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.227.52.248 (0.006 с.) |