Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Способы потенциометрического анализаСодержание книги Похожие статьи вашей тематики
Поиск на нашем сайте
Ионометрия, рН-метрия Способ определения концентрации ионов по измерению потенциала ионоселективного мембранного электрода называют ионометрией. Приборы для прямой потенциометрии называют иономерами. Наиболее широкое применение нашла прямая потенциометрии для определения рН растворов с использованием стеклянного электрода. Потенциал стеклянного электрода описывается уравнением
E = k – 0,059 рН
В качестве электрода сравнения используется хлорсеребряный электрод. Электроды помещают в анализируемый раствор и измеряют рН этого раствора с помощью прибора рН-метра. При использовании других ионоселективных электродов готовят ряд растворов с известными концентрациями анализируемых ионов. Строят градуироваочный график зависимости потенциала индикатороного электрода от отрицательного десятичного логарифма к концентрации анализируемого иона. Измерив потенциал индикаторного электрода в растворе с неизвестной концентрацией, по градуировочному нрафику находят его концентрацию.
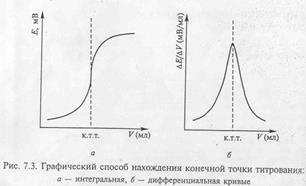
Потенциометрическое титрование Зависимость потенциала индикаторного электрода от состава раствора используют для нахождения объёма в конечной точке титрования. Объём титранта в конечной точке титрования находят разными способами. Строят кривую титрования в координатах: потенциал – объём титранта (интегральная кривая) и графически находят объём титранта в конечной точке титрования. Слайд 9
Другой способ состоит в построении дифференциальной кривой: на оси ординат откладывают отношение ∆ E/∆V, а на оси абсцисс – объём прибавленного титранта V. Максимум на кривой титрования соответствует объёму титранта в конечной точке титрования. КУЛОНОМЕТРИЧЕСКИЙ АНАЛИЗ (КУЛОНОМЕТРИЯ) Принципы метода. Кулонометрический анализ (кулонометрия) основан на использовании зависимости между массой m вещества, прореагировавшего при электролизе в электрохимической ячейке, и количеством электричества Q, прошедшего через электрохимическую ячейку при электролизе только этого вещества. В соответствии с объединённым законом электролиза Фарадея масса m (в граммах) связана с количеством электричества Q (в кулонах) соотношением
m = QM/nF, (1) где M – молярная масса вещества, прореагировавшего при электролизе, г/моль; n – число электронов, участвующих в электродной реакции; F – 96487 Кл/моль – число фарадея. Количество электричества Q (в Кл), прошедшее при электролизе через электрохимическую ячейку, равно произведению электрического тока i (в А) на время электролиза τ (в с);
Q = iτ (2) Если измерено количество электричества Q, то согласно (1)можно рассчитать массу m. Это справедливо в том случае, когда всё количество электричества Q, прошедшее при электролизе через электрохимическую ячейку, израсходовано только на электролиз данного вещества; побочные процессы должны быть исключены, т.е. выход по току должен быть равен 100%. Главная задача кулонометрических измерений – как можно более точно определить количество электричества Q. Кулонометрический анализ проводят либо в гальваностатическом режиме, т.е. при постоянном электрическом токе, либо при контролируемом постоянном потенциале рабочего электрода (потенциостатическая кулонометрия), когда электрический ток уменьшается в процессе электролиза. В первом случае для определения количества электричества Q достаточно как можно более точно измеритьвремя электролиза τ (с), постоянный ток i (А) и рассчитать величину Q по формуле (2). Во втором случае величину Q определеяют либо расчётным способом, либо с помощью химических кулонометров. Различают прямую кулонометрию и косвенную кулонометрию (кулонометрическое титрование).
Прямая кулонометрия
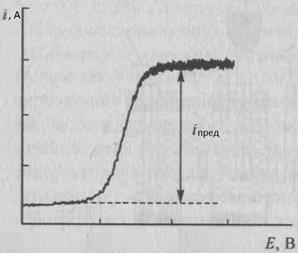
Сущность метода. Прямую кулонометрию при постоянном токе применяют редко. Чаще используют кулонометрию при контролируемом постоянном потенциале рабочего электрода или прямую потенциостатическую кулонометрию. В прямой потенциостатичекой кулонометрии электролизу подвергают непосредственно определяемое вещество. Измеряют количество электричества, затраченное на электролиз этого вещества, и по уравнению (1) рассчитывают массу m определяемого вещества. В процессе электролиза потенциал рабочего электрода поддерживают постоянным, E = const, для чего обычно используют приборы – потенциостаты. Постоянное значение потенциала E выбирают предварительно на основании рассмотрения вольт – амперной кривой, построенной в координатах токi – потенциал E, полученной в тех же условиях, в которых будет проводиться электролиз. Обычно выбирают значение потенциала E, соответствующее области предельного тока для определяемого вещества.
Рис1, Харитонов, стр. 468
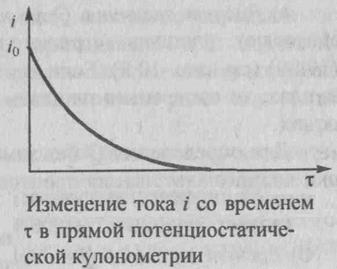
По мере протекания процесса электролиза при постоянном потенциале электрический ток в ячейке уменьшается, так как понижается концентрация электроактивного вещества, участвующего в электродной реакции. При этом электрический ток уменьшается со временем по экспоненциальному закону от начального значения io в момент времени τ = 0 до значения i в момент времени τ
i = io ∙e-kτ, где k= const. (3) График функции (3) схематично показан на рис. 2
Рис.2 изменение тока i со временем τ в прямойпотенциостатической кулонометрии.
Выход по току будет количественным, когда ток i уменьшится до нуля, т.е. при бесконечно большом времени τ. На практике электролиз определяемого вещества считают количественным, когда ток достигает очень малой величины, не превышающей ~0,1% от значения io. Общее количество электричества Q, затраченное на электролиз определяемого вещества, равно
Q = ∫idτ, (4)
т.е. определяется площадью, ограниченной осями координат и экспонентой на рис.2 Для нахождения массы m прореагировавшего вещества требуется согласно (1) измерить или рассчитать количество электричества Q. Способы определения количества электричества, прошедшего через раствор, в прямой потенциостатической кулонометрии. Величину Q можно определить расчётными способами либо с помощью химического кулонометра. а) Расчёт величины Q по площади под кривой зависимости i от τ. Измеряют площадь, ограниченную осями координат и экспонентой (3) (см. рис. 2). Если ток i выражен в амперах, а время τ - в секундах, то измеренная площадь равна количеству электричества Q в кулонах. б) Расчёт величины Q на основе зависимости In i от τ. В соответствии с (3) и (4) имеем:
формула, Харитонов, стр. 484, уравн.11 (5)
Таким образом, Q = io/k и для определения величины Q необходимо найти значения io и k. Согласно (3) i = ioe -kτ. После логарифмирования этого уравнения получим линейную зависимость In i от τ:
In i = In io – kτ (6) Если измерить несколько значений i в различные моменты времени τ то можно построить график функции (6), схематически показанной на рис.3 и представляющий собой прямую линию.
Рис.3. Зависимость In i от времениэлектролиза τ в прямой потенциостатической кулонометрии.
Отрезок, отсекаемой прямой линией на оси ординат In io, а тангенс угла φ наклона прямой к оси абсцисс равен tgφ = - k. Зная значения k иIn io, а следовательно, io, можно рассчитать величину Q = io/k, а затем и массу m по формуле (1). в) Определение величины Q с помощью химического кулонометра. При этом способе в электрическую цепь кулонометрической установки включают химический кулонометр последовательно с электрохимической ячейкой, в которой проводят электролиза определяемого вещества. Количество электричества Q, проходящее через последовательно соединённые кулонометр и электрохимическую ячейку, одинаково. Конструкция кулонометра позволяет экспериментально определить величину Q, Чаще всего применяют серебряный, медный и газовые кулонометры, Использование серебряного и медного кулонометров основано на электрогравиметрическом определении массы серебра или меди, осаждающейся на платиновом катоде при электролизе. Зная массу металла, выделяющегося на катоде в кулонометре, можно рассчитать количество электричества Q. Медный кулонометр содержит платиновые катод и анод, погружённые в сернокислый раствор соли меди (CuSО4). При электролизе на катоде выделяется металлическая медь:
Cu2+ + 2e = Cu
массу которой определяют, взвешивая платиновый катод до и после электролиза. Масса 0,3295 мг меди, осаждённой на платиновом катоде, отвечает затрате на электролиз 1 Кл электричества. Кулонометры, особенно – серебряный и медный, позволяют определять количество электричества Q с высокой точностью, однако работа с ними довольно трудоёмка и продолжительна. Поэтому чаще применяют косвенную кулонометрию – кулонометрическое титрование.
|
||||
|
Последнее изменение этой страницы: 2016-08-16; просмотров: 1061; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.188.13.127 (0.01 с.) |