Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Физико-химические методы анализаСодержание книги Похожие статьи вашей тематики
Поиск на нашем сайте
ФИЗИКО-ХИМИЧЕСКИЕ МЕТОДЫ АНАЛИЗА
Киров 2012 УДК 544 (075.8) ББК 24.5я73 Ф 50
Печатается по решению ЦМС Кировской государственной медицинской академии (Протокол № _4 __ от «_ 27 __»__ декабря __ 2012_ г.)
Физико-химические методы анализа: учебное пособие для студентов вузов /сост.: И. В. Горева, И. А. Токарева. - Киров: Кировская ГМА, 2012. – 65 с.
В учебном пособии приведена классификация и теоретические основы методов физико-химических исследований. Содержится информация о возможности использования различных физико-химических методов для определения состава и качества продовольственных товаров и пищевого сырья. В учебном пособии приведены тестовые задания для самостоятельной работы студентов по дисциплине «Физико-химические методы исследования». Учебное пособие «Физико-химические методы анализа» для направления подготовки «Товароведение» публикуется впервые и не имеет аналогичных изданий, поэтому является необходимым и своевременным для профессиональной подготовки товароведов-экспертов. Учебное пособие предназначено для студентов высших учебных заведений, изучающих дисциплину «Физико-химические методы исследования», специализирующихся в области товароведения и экспертизы продовольственных товаров, а также может быть использовано для подготовки студентов медицинских специальностей.
Рецензент: заведующий кафедрой химии Кировской ГМА, д.м.н. П.И. Цапок
© Горева И.В., Токарева И.А. – Киров, 2012 © ГБОУ ВПО Кировская ГМА Минздрава РФ СОДЕРЖАНИЕ ВВЕДЕНИЕ………………………………………………………………............. ……4 МЕТОДИЧЕСКИЕ УКАЗАНИЯ………………………………………………………5 I. ОБЩАЯ ХАРАКТЕРИСТИКА ФИЗИКО-ХИМИЧЕСКИХ МЕТОДОВ ИССЛЕДОВАНИЯ …………………………………………………………………….6 1.1. Классификация методов исследования…………………………………………..6 1.2. Планирование эксперимента…………………………………………………….15 1.3.Выбор метода исследования. Метрологические характеристики физико-химических методов анализа……………………………………………….18 1.4. Этапы аналитического исследования. Методы отбора проб и пробоподготовки………22 II. Прикладное использование физико-химических методов исследования……………………………………………………………………27 2.1. Оптические и спектральные методы……………………………………………27 2.2. Электрохимические методы……………………………………………………..46 2.3. Методы разделения и концентрирования………………………………………51 III. ТЕСТОВЫЕ ЗАДАНИЯ С ЭТАЛОНАМИ ОТВЕТОВ…..……………………..56 Приложение……………………………………………………………………………63 Список литературы……………………………………………………………………65
ВВЕДЕНИЕ В настоящее при осуществлении контроля качества сырья и готовой продукции, а также для регулирования технологических процессов в пищевой промышленности, значительно возросла доля современных физико-химических методов анализа. При проведении исследований реализуется все большее число новых подходов и принципов анализа, применяются специализированные приборы и автоматические системы. Возрастает доля приборов, в которых используются комбинированные методы исследования. Используемые в настоящее время, аналитические методы обеспечивают простоту и скорость проведения исследований, обладают высокой точностью и воспроизводимостью результатов, имеют высокую чувствительность. Современному специалисту необходимо знать принципы основных методов исследования, уметь выбирать наиболее оптимальный метод для проведения исследования, учитывая его метрологические характеристики. Важным этапом в проведении исследования является отбор пробы и пробоподготовка. Пособие предназначено для студентов высших учебных заведений, специализирующихся в области товароведения и экспертизы продовольственных товаров. Учебное пособие включает таблицы, схемы, рисунки приборов, используемые для проведения экспертизы товаров. В учебном пособии приведен теоретический материал и показано прикладное значение данных методов анализа для экспертизы продовольственных товаров и сырья.
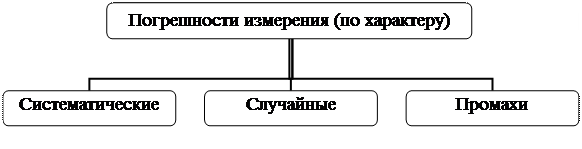
Методические указания Целью данного пособия является формирование системы теоретических знаний и развитие умений студентов в выборе и применении конкретных физико-химических методов для исследования состава и качества продуктов питания. Учебное пособие по физико-химическим методам анализа составлено в соответствии с рабочей программой дисциплины «Физико-химические методы исследования» по направлению подготовки 100800 «Товароведение», которой предусмотрено 144 часа, в том числе: лекций – 18 часов, лабораторных занятий – 36 часов, самостоятельной работы – 54 часа. В ходе изучения дисциплины «Физико-химические методы исследования» реализуются следующие дидактические задачи: - краткое и четкое изложение наиболее значимых для изучения товароведения и экспертизы товаров сведений об основах физико-химических методов исследований, их использовании для определения состава и качества пищевых продуктов; - обучение студентов соответствующим аспектам практического использования полученных знаний; - развитие навыков выполнения химических расчетов и обработки полученных при выполнении исследований результатов; - развитие навыков статистической обработки результатов; - развитие любознательности, творческой активности, интереса к научно – исследовательской работе; - знакомство студентов с прикладными аспектами изучаемого курса, связанными с профессиональной деятельностью. В результате самостоятельной работы с данным пособием студент должен знать: – классификационные признаки методов исследования; – классификацию физико-химических методов исследования в зависимости от аналитического сигнала; – теоретические основы физико-химических методов исследования; – устройство и принцип работы приборов, используемых при проведении физико-химических исследований; – способы математической и статистической обработки данных, полученных при исследовании; В результате изучения дисциплины студент должен уметь: – выбирать метод анализа конкретного образца; – составлять алгоритм проведения анализа; – применять приборы различных методов анализа для проведения экспертизы качества продуктов питания; – делать расчет на любой стадии эксперимента, включая приготовление необходимых реактивов и статистическую обработку результатов эксперимента; – сопоставлять альтернативные методы, способы, методики анализа. В каждой теме для самостоятельной подготовки студентов приведены вопросы для самоконтроля, а также тестовые задания, которые помогут более глубоко разобраться в сущности описанных методов. I. ОБЩАЯ ХАРАКТЕРИСТИКА ВОПРОСЫ ДЛЯ САМОКОНТРОЛЯ 1. Что такое «аналитический сигнал»? Приведите примеры аналитического сигнала. 2. Приведите классификационные признаки методов исследования. 3. Какие существуют методы исследования в зависимости от применяемых средств измерения? 4. Приведите классификацию методов по природе аналитического сигнала. 5. На какие группы делятся методы физико-химического анализа в зависимости от вида аналитического сигнала? 6. В чем отличие качественного и количественного анализа? Планирование эксперимента Экспериментом называется совокупность опытов, объединенных единой целью, единой системой ограничений в пространстве и времени. Опытом можно считать реализацию на каком-либо объекте некоторых условий, правил. В результате чего появляется то или иное событие. Появление события регистрируется при помощи какого-либо параметра, имеющего, как правило, численное значение и наиболее полно характеризующего результат. Такой параметр отражает эффективность события и называется критерием оптимальности (у). Всеобъемлющим, глобальным критерием оптимальности является экономический критерий. Частным критерием оптимальности может быть любой технологический параметр, характеризующий технологический результат процесса, такой критерий называют выходом процесса. Результат процесса зависит от условий его протекания, характеризуемых значениями параметров, влияющих на процесс. Независимые параметры процесса называют факторами. Оптимизация процесса (объекта) сводится к отысканию таких условий его протекания (конструктивных размеров, технологических параметров и т.д.), при которых критерий оптимальности будет иметь экстремальное значение: максимум, если численное значение критерия оптимальности означает увеличение эффективности процесса (объекта), или минимум, если его увеличение означает снижение эффективности процесса (объекта). Условия проведения каждого опыта эксперимента в виде конкретного значения исследуемых факторов, а иногда и очередность проведения опытов регламентируются планом эксперимента. Планирование эксперимента включает следующие этапы проведения исследования: 1 этап – изучение сведений об исследуемом объекте; 2 этап – формулирование систем предпосылок, призванных ограничить объект в пространстве и времени, выделить главные черты объекта, упростить схему взаимодействия элементарных процессов внутри объекта и объекта с окружающей средой; 3 этап – создание модели объекта, которой может быть: - сам объект, ограниченный в пространстве и времени, с упрощенной схемой взаимодействия элементарных процессов внутри объекта и объекта с окружающей средой; - дубликат объекта, уменьшенный или увеличенный по сравнению с натурным объектом, созданный на основе теории подобия. 4 этап – исследование модели объекта на основе применения наиболее эффективных и экономичных методов математического планирования экспериментов, современных приборов и методик; 5 этап – анализ экспериментальных данных методами математической статистики и формализации этих данных (создание адекватной математической модели объекта); 6 этап – использование полученной математической модели для решения поставленных задач; 7 этап – экспериментальная проверка полученного решения; 8 этап – составление отчета по научному исследованию. Планы, обеспечивающие получение наименьшей величины максимальной дисперсии предсказания, называют G-оптимальными. Планы, обеспечивающие получение одинаковых дисперсий предсказания для точек, равноотстоящих от центра эксперимента, называют ротатабельными. Планы, обеспечивающие получение одинаковой величины дисперсии предсказания для любой точки в пределах изучаемой области, называют униформ-ротатабельными. D-оптимальными называют планы, обеспечивающие получение минимальной обобщенной дисперсии коэффициентов уравнения. Планы, обеспечивающие получение уравнения, коэффициенты которого независимы друг от друга и имеют одинаковую дисперсию, называют ортогональными. По результатам опытов, следуя определенному алгоритму, получают соответствующее уравнение, характеризующее влияние факторов на эффективность исследуемого процесса. Математизация исследований предполагает получение математической модели исследуемого процесса, достаточно точно, адекватно его описывающей. При наличии такой модели возникает возможность дальнейшие исследования процесса заменить анализом его математической модели для получения решения поставленных задач. Применение вероятностно-статистических методов для изучения сложных технологических систем возможно в двух направлениях: · статистический анализ полученных экспериментальных данных с целью определения однородности собранного материала, его достоверности и точности с позиции принятого уровня значимости, его достаточности для принятия тех или иных решений; · разработка математико-статистических моделей, используемых в дальнейшем для оптимального управления процессом или оптимального конструирования объекта и т.д. Различают так называемые теоретические (эвристические) модели, описывающие механизм происходящих в объекте физико-химических и механических процессов на микро- и макроуровнях, и модели эмпирические (статистические, или стохастические). Методы математического планирования эксперимента позволяет получить математические модели в реализованном диапазоне изменения многих факторов, влияющих на процесс, наиболее экономичным и эффективным способом. Несовпадение результатов эксперимента с ожидаемыми или стандартными значениями называется ошибкой (погрешностью). Ошибка или погрешность – это оценка отклонения измеренного значения величины от её истинного значения. В зависимости от характера проявления выделяют следующие погрешности (рисунок 6):
Рисунок 6 – Виды ошибок (погрешностей) по характеру Систематические ошибки (погрешности) – погрешности измерения, повторяющиеся и неменяющиеся при определении, одинаковые по знаку и влияющие на результат. Положительные систематические ошибки приводят к завышению значения определяемой величины, отрицательные к его занижению. Систематические ошибки могут возникнуть из-за направленного изменения во времени влияния на процесс какого-либо неучтенного фактора. Если величина систематической ошибки становится известна исследователю, а исключить причины, вызвавшие ее появление, не представляется возможным, то в результаты вносят соответствующие поправки. Постоянные или аддитивные систематические ошибки связаны с абсолютным значением аналитического сигнала, пропорциональные или мультикативные - пропорциональны значению измеряемого аналитического сигнал зависимости от причин появления, выделяют несколько видов систематических ошибок (рисунок 7). Причиной методических ошибок являются ошибки, которые зависят от особенности применяемого метода (неполное протекание реакции, частичное растворение осадка, свойство индикатора). Оперативные ошибки возникают при погрешностях выполнения отдельных операций – недостаточное промывание осадка на фильтре, неточное взвешивание. Индивидуальные – ошибки лаборантов (способность точно определять окраску при титровании, психологические ошибки). Инструментальные - связаны с недостаточной точностью используемых приборов. Случайные ошибки – возникающие при определениях случайные погрешности измерения, которые меняются от опыты к опыту. Неконтролируемое случайное изменение, влияющее на процесс, вызывает случайные отклонения измеряемой величины от ее истинного значения. Следовательно, результаты параллельных опытов образуют набор случайных величин. Статистический анализ экспериментальных данных основывается на том, что эти данные являются случайной величиной, распределенной по нормальному закону.
Рисунок 7 – Виды систематических ошибок Промахи – грубые ошибки, которые обусловлены неправильными подсчетами, потерей части раствора, просыпанием осадка. Таким образом, причинами случайных ошибок и промахов могут быть: резкое изменение условий проведения опыта, невнимательность экспериментатора, ошибки при проведении расчетов, то есть субъективные факторы. ВОПРОСЫ ДЛЯ САМОКОНТРОЛЯ 1. Перечислите этапы научного экспериментального исследования объекта. 2. Какие существуют виды погрешностей по характеру их проявления? 3. Охарактеризуйте виды систематических ошибок. 4. Что необходимо учитывать при выборе метода анализа? 5. Какие виды метрологических характеристик существуют? 6. Приведите определение понятий: «воспроизводимость», «селективность», «точность». 7. От чего зависит «чувствительность» метода? 8. Как рассчитываются абсолютная и относительная систематическая ошибка? 9. Приведите формулу для расчета среднего квадратичного отклонения. ВОПРОСЫ ДЛЯ САМОКОНТРОЛЯ 1. Из каких этапов складывается проведение аналитического исследования? 2. Какие бывают виды проб? Приведите их характеристику. 3. Каков порядок отбора различных видов проб? 4. Что такое пробоподготовка и какие этапы она включает? 5. Перечислите способы минерализации проб.
ВОПРОСЫ ДЛЯ САМОКОНТРОЛЯ 1. Перечислите основные характеристики электромагнитного излучения. 2. Какие признаки положены в основу классификации оптических и спектральных методов исследования? 3. Что положено в основу метода рефрактометрии? 4. Где используется метод рефрактометрии? 5. Что такое спектральный метод и какие типы приборов в нем используются? 6. Приведите классификацию спектральных методов анализа. 7. Какие преимущества и недостатки имеет спектральный анализ? 8. Где находит применение метод атомной спектроскопии? 9. Что положено в основу метода масс-спектроскопии и где он применяется? 10. Назовите методы фотометрического анализа. 11. Какие группы люминесцентного анализа существуют? 12. В чем сущность поляриметрического анализа? 13. В каких случаях применяется поляриметрический анализ?
Электрохимические методы Электрохимические методы основаны на взаимодействии вещества с электрическим током. Методы количественного электрохимического анализа делятся следующим образом: потенциометрия; кондуктометрический метод, полярографический анализ; амперометрическое титрование и кулонометрическое титрование. Потенциометрический метод Метод основан на титровании с применением специально подобранного индикаторного электрода. Этот метод применяется для окрашенных или мутных растворов, для анализа смесей нескольких близких по свойствам компонентов. Потенциометрический анализ – метод определения концентрации ионов, основанный на измерении электрохимического потенциала погруженного в испытуемый раствор электрода. Простейшая потенциометрическая схема содержит два электрода: потенциал одного из них прямо или косвенно зависит от концентрации определяемых ионов – его называют индикаторным электродом; и второй электрод, относительно которого измеряется потенциал индикаторного электрода, называется электродом сравнения. Измерив разность потенциалов между индикаторным и стандартным электродами, и зная величину потенциала стандартного электрода, вычисляют потенциал индикаторного электрода. Индикаторные электроды имеют следующие типы: - электроды первого порядка, к ним относят серебряные и ртутные электроды. То есть, электродами являются инертные металлы, которые не принимают участия в реакции, а служат лишь передатчиками электронов между компонентами окислительно-восстановительной системы; - электроды второго порядка представляют собой металл, покрытый слоем малорастворимой соли этого же металла. В этом случае электрод сам является одним из элементов системы, определяющей потенциал. К этим электродам относят каломельный электрод, мембранный электрод, металлоксидный. В последнее время широкое применение приобрел стеклянный электрод. Выбор индикаторного электрода при потенциометрическом титровании определяется типом протекающей реакции и природой присутствующих в растворе ионов. Выбор электрода также зависит от условий титрования, наличия загрязнений, присутствия окислителей или восстановителей, интервала изменения рН во время титрования и от удобства работы. Потенциометрический метод был разработан ещё в конце прошлого столетия. Существуют два основных варианта: абсолютная потенциометрия и потенциометрическое титрование. Абсолютная потенциометрия – измерение потенциала металлического электрода, погруженного в исследуемый раствор, и вычисление концентрации определяемых ионов производится непосредственно по уравнению. Потенциометрическое титрование – заключается в том, что в испытуемый раствор погружают индикаторный электрод и титруют раствор, измеряя в процессе титрования потенциал электрода.
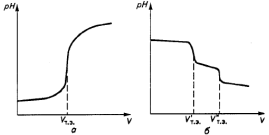
а – одного вещества, б – смеси двух веществ Рисунок 30 – Кривые потенциометрического титрования При потенциометрическом титровании используются реакции кислотно-основного взаимодействия, окисления – восстановления, осаждения и комплексообразования, в ходе которых изменяется концентрация потенциалобразующих ионов. Потенциометрическое титрование используют при титровании окрашенных растворов, когда цветные индикаторы неприменимы. Потенциометрическое титрование является объемно-аналитическим методом, в котором конец титрования определяют по резкому изменению потенциала индикаторного электрода вблизи точки эквивалентности (рисунок 30). Ордината точки перегиба на кривой потенциометрического титрования соответствует потенциалу электрода в конце титрования, а абсцисса – объему рабочего раствора, израсходованного на его определение, т.е. конечной точке титрования (рисунок 30 а). Данным методом можно определить несколько веществ без предварительного разделения. В этом случае на кривой титрования появятся несколько скачков потенциала (рисунок 30 б), по которым находят объем рабочего раствора, израсходованного на взаимодействие с каждым компонентом сложного раствора. Для измерения рН применяются потенциометры различных марок. На рисунке 31 изображен внешний вид потенциометра марки «Анион 4100».
Рисунок 31 – Внешний вид потенциометра «Анион 4100» Амперометрическое титрование Амперометрическое титрование – метод анализа, в котором индикаторным электродом служит полярографическое устройство. Этот вид электрохимических исследований можно рассматривать как вариант потенциометрического титрования, отличающийся тем, что применяется микроэлектрод с наложенным напряжением. Ток возникает вследствие восстановления (или окисления) определяемого вещества на электроде, титрующего реагента или обоих веществ.
а – начало титрования; б – окончание титрования Рисунок 32 – Кривые амперометрического титрования Зависимость силы тока восстановления или окисления вещества от его концентрации в растворе может быть использована для определения конца титрования. Зависимость силы тока от прибавленного объема тирующего реагента имеет вид двух прямых с точкой перегиба в конце титрования, которую и используют для установления объема реагента (рисунок 32). Основным преимуществом амперометрического титрования является большая чувствительность по сравнению с потенциометрией. Метод применяется обычно в тех случаях, когда требуется подобрать подходящий индикаторный электрод для потенциометрического титрования. Высокая чувствительность и селективность метода позволяет определять целый ряд неорганических и органических соединений без предварительного их выделения. Метод амперометрического титрования применен для определения содержания кальция, магния и кадмия в различных пищевых продуктах, таких как рис, молоко, бананы, яблоки, капуста. Амперометрический метод применяется так же для определения концентрации растворенного кислорода в вине и коньячном спирте. Сила тока, проходящего через электроды, пропорциональна концентрации кислорода в анализируемой среде. Кондуктометрический анализ Метод основан на титровании, окончание которого определяют по перегибу кривой зависимости электропроводимости от количества прибавленного титрованного рабочего раствора. Серьезным препятствием для применения метода является присутствие посторонних электролитов, увеличивающих фон проводимости, что уменьшает чувствительность и точность метода. Один из методов кондуктометрии представляет собой высокочастотное титрование. Применение тока высокой частоты позволяет пользоваться системой без погружения в раствор электролитов.
Кулонометрическое титрование Кулонометрический анализ является абсолютным и основан на измерении количества электрического тока, затрачиваемого на реакцию с определяемым компонентом. Метод только формально называется титрованием. О количестве вещества судят по количеству затраченного электрического тока. Легко поддающиеся измерению величины и относительная простота аппаратуры делают этот метод одним из удобных для применения в практике. На основе кулонометрического титрования могут быть созданы удобные и простые автотитраторы, значительно превышающие по своим эксплутационным характеристикам и надежности существующие приборы, основанные на дозированной подаче титрующих растворов. Кулонометрии присуще высокая правильность, воспроизводимость и малая погрешность анализа. Главные трудности заключаются в том, чтобы избежать побочных реакций на электродах. При электролизе (электрохимическом разложении) растворов органических и особенно неорганических веществ все количество электричества, прошедшее через раствор расходуется только на окисление или восстановление. Измерив количество электричества, израсходованного за время протекания реакции до полного разложения реагирующего вещества, можно определить содержание этого вещества, основываясь на известных законах электролиза. Единица количества электричества – кулон (Кл) и дала название методу анализа – кулонометрия. Метод применяется для анализа органических соединений и определения всех элементов всех групп периодической системы Менделеева. Кулонометрия также служит для анализа газов и на её основе разработаны многочисленные автоматические газоанализаторы, с помощью которых определяют содержание водорода, кислорода, воды, оксидов углерода, азота и серы, галогены и их производные. Полярографическийанализ Полярографический метод анализа является одним из электрохимических методов. Этот метод основан на изучении явлений, происходящих на капельном ртутном катоде. Название метода связано с процессами поляризации, возникающими при пропускании электрического тока через растворы электролитов.
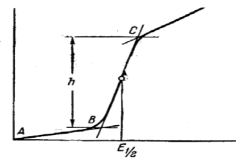
Рисунок 33 – Полярографическая волна Области применения данного метода разнообразны. Его можно использовать для исследования механизма электродных процессов, для определения ряда физико-химических констант, изучения кинетики химических реакций и т.п. так же полярографический метод широко применяется в аналитической химии для качественного обнаружения и количественного определения многих неорганических и органических веществ. Так, например, для определения содержания некоторых металлов в раствор погружают сразу два электрода. Обычно берут анод (слой ртути) с постоянным потенциалом и большой поверхностью, а катод с малой поверхностью (чаще всего катодом служит капля ртути, вытекающая из капилляра). Электроды соединяют с источником постоянного тока и постепенно увеличивают напряжение на электродах. При этом ток почти не идет, затем начинается электровыделение металла и сила тока растет с напряжением. Однако увеличение силы тока продолжается до известного предела и зависит от концентрации определяемых ионов. Зависимость силы тока от приложенного напряжения выражается кривой с перегибами – волнами. По кривой зависимости можно судить о составе и концентрации электролита, т.е. провести качественный и количественный анализ раствора (рисунок 33). Е1/2 – потенциал полуволны. По значению потенциала полуволны можно качественно обнаружить вещество. Особенно часто потенциал полуволны применяют при качественном анализе органических соединений. ВОПРОСЫ ДЛЯ САМОКОНТРОЛЯ 1. На чем основаны электрохимические методы и на какие виды они делятся? 2. В каких случаях применяется потенциометрический метод и в чем его сущность? 3. В чем преимущество амперометрического титрования и в каких случаях он применяется? 4. Каковы преимущества и недостатки кулонометрического титрования? 5. Где используется кулонометрического титрование? 6. Каковы области применения метода полярографии?
ВОПРОСЫ ДЛЯ САМОКОНТРОЛЯ 1. В каких случаях применяют методы разделения и концентрирования? 2. Перечислите методы концентрирования и охарактеризуйте их. 3. Какие существуют группы методов разделения? 4. В чем суть метода экстракции и каковы достоинства и недостатки данного метода? 5. В чем суть хроматографического метода исследования? 6. Какие признаки положены в основу классификации хроматографических методов? III. ТЕСТОВЫЕ ЗАДАНИЯ 1. Принцип, положенный в основу анализа безотносительно к конкретному объекту и определяемому веществу называется: а) методика; б) метод; в) аналитический сигнал; 2. К физико-химическим методам не относятся: а) электрохимические; б) хроматографические; в) титриметрические; г) масс-спектрометрические; 3. Аналитическим сигналом оптического метода может быть: а) излучение; б) изменение массы вещества; в) температура; г) плотность; 4. Излучение, поглощение или отражение лучистой энергии веществом происходит при воздействии на его структурные частицы излучением в диапазоне длин волн: а) от 100 нм до 1мм; б) от 10 до 100 нм; в) от 1мк до 1 мм; г) < 100 нм; 5. К оптическим методам анализа не относится: а) эмиссионный спектральный анализ; б) фотоколориметрия; в) потенциометрия; г) нефелометрия; 6. Определение элементного состава вещества по спектрам, излучаемым парами вещества, называется: а) спектрофотометрия; б) фотоколориметрия; в) флуоресцентный анализ; г) эмиссионный спектральный анализ; 7. Метод определения концентрации вещества по показателю преломления света называется: а) спектрофотометрия; б) фотоколориметрия; в) рефрактометрия; г) поляриметрия; д) нефелометрия; 8. Значение показателя преломления не зависит от: а) температуры; б) природы падающего света; в) длины волны; г) концентрации; д) давления; 9. Свойство веществ излучать свет под воздействием возбуждающих факторов называется: а) преломление света; б) люминесценция; в) светопропускание; г) оптическая плотность; 10. Мгновенное свечение, возникающее в момент возбуждения светящегося объекта, называется: а) фотолюминесценцией; б) флюоресценция; в) фосфоресценция; г) рентгенолюминесценцией; д) хемилюминесценцией; 11. Тип свечения, возникающий вследствие образования избыточной энергии в самом веществе, называется: а) самостоятельное; б) вынужденное; в) рекомбинационное; 12. Подсолнечное масло в люминоскопе: а) светится синим светом; б) светится желтым светом; в) светится голубоватым светом; г) не имеет характерного свечения; 13. Коровье масло при облучении ультрафиолетовыми лучами: а) светится синим светом; б) светится желтым светом; в) светится голубоватым светом; г) не имеет характерного свечения; 14. Молоко коровье, в котором начались процессы скисания, при облучении ультрафиолетовыми лучами: а) светится синим светом; б) светится желтым светом; в) светится голубоватым светом с фиолетовыми точками; г) не имеет характерного свечения; 15. Электрические параметры системы являются аналитическим сигналом: а) химических методов; б) хроматографических методов; в) оптических методов; г) электрохимических методов; 16. К электрохимическим методам не относятся: а) гравиметрия; б) кондуктометрия; в) потенциометрия; г) полярография; 17. Определение рН растворов с помощью рН-метра относится к: а) гравиметрии; б) кондуктометрии; в) потенциометрии; г) полярографии; 18. Минимальное количество вещества, которое можно обнаружить или определить данным методом, по данной методике называется: а) чувствительностью; б) пределом обнаружения; в) воспроизводимостью; г) селективностью; д) правильностью; 19. Близость полученного и истинного значения измеряемой величины называется: а) чувствительностью; б) пределом обнаружения; в) воспроизводимостью; г) селективностью; д) правильностью; 20. Метод, основанный на измерении поглощения света окрашенными растворами, называется: а) эмиссионный спектральный анализ; б) фотоколориметрия; в) потенциометрия; г) нефелометрия 21. Продукты, содержащие влаги от 10 до 40 % относятся к продуктам: а) высокой влажности; б) средней влажности; в) низкой влажности; 22. Вода, находящаяся между клетками продукта называется: а) гидратационная вода; б) свободная вода; в) связанная или иммобилизованная вода; 23. Для белков не характерны процессы: а) гидратация; б) дегидратация; в) денатурация; г) деструкция; д) пиролиз; 24. Удаление из продукта свободной и части связанной воды относится к гидратации: а) необратимой; б) обратимой; в) смешанной; г) первичной; 25. Денатурация белка, протекающая при механическом воздействии исопровождающаяся образованием пленок, называется: а) поверхностной денатурацией; б) тепловой денатурацией; в) деструкцией; г) дегидратацией; 26. К липидам пищевых продуктов не относятся: а) триглицериды; б) фосфолипиды; в) пигменты; г) дипептиды; 27. Омылением жиров называется: а) гидролизом жиров в щелочной среде; б) гидролизом жиров в кислой среде; в) окислением жиров; г) прогорканием жиров; 28. Лактоза относится к: а) моносахаридам; б) дисахаридам; в) полисахаридам; 29. Процесс выделения твердого вещества из раствора при охлаждении называется: а) высаливание; б) перекристаллизация; в) перегонка; г) экстрагирование; д) озоление; е) осаждение; 30. Процесс перевода жидкого вещества в пар и конденсации последнего в жидкость для отделения летучих веществ от нелетучих называется: а) высаливание; б) перекристаллизация; в) перегонка; г) экстрагирование; д) озоление; 31. Процесс извлечения веществ из смеси или раствора, при понижении растворимости данного компонента, называется: а) высаливание; б) перекристаллизация; в) перегонка; г) экстрагирование; 32. Выделение из раствора малорастворимого или нерастворимого осадка, образованного в результате различных химических реакций называется: а) перекристаллизация; б) перегонка; в) экстрагирование; г) осаждение 33. Высаливание является разновидностью а) перегонки; б) экстрагирования; в) осаждения; 34. К растворимым в воде белкам относятся: а) миоген, миоальбумин, миоглобин; б) миозин, актин; в) белки сарколеммы (коллаген, эластин, муцин); 35. К солерастворимым белкам относятся: а) миоген, миоальбумин, миоглобин; б) миозин, актин; в) белки сарколеммы (коллаген, эластин, муцин); 36. К нерастворимым белкам относятся: а) миоген, миоальбумин, миоглобин; б) миозин, актин; в) белки сарколеммы (коллаген, эластин, муцин); 37. При добавлении к гомогенизированной мышечной ткани воды, в раствор переходят: а) альбуминовая фракция; б) глобулиновая фракция в) белки стромы; 38. Глобулиновая
|
|||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-18; просмотров: 1759; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.134.117.239 (0.013 с.) |