
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Качественный элементный анализСодержание книги Поиск на нашем сайте
МЕТОДИЧЕСКИЕ УКАЗАНИЯ к лабораторным занятиям по курсу «Органическая химия» для студентов специальностей 48 01 02, 49 01 01, 49 01 02, 91 01 01
Могилев 2004
УДК 547.1 + 543 Рассмотрены и рекомендованы к изданию кафедрой Протокол № 7 от 30 апреля 2004 г. Составители: доцент, к.х.н. Гузиков А.Я. доцент, к.х.н. Баранов О.М. Рецензент доцент, к.т.н. Трилинская Е.А. Ó Могилевский государственный университет продовольствия Содержание 1 КАЧЕСТВЕННЫЙ ЭЛЕМЕНТНЫЙ АНАЛИЗ. 7 1.1 Отношение органического вещества к нагреванию.. 7 1.2 Открытие углерода и водорода в органическом веществе. 8 1.3 Открытие азота, серы и галоидов в органическом веществе. 8 1.3.1 Проба на серу. 10 1.3.2 Проба на азот. 10 1.3.3 Проба на галоиды.. 11 1.3.4 Проба Бейльштейна на галоиды.. 11 2 КАЧЕСТВЕННЫЙ ФУНКЦИОНАЛЬНЫЙ АНАЛИЗ. 13 2.1 Кратная связь. 13 2.1.1 Реакция с бромом. 13 2.1.2 Реакция с перманганатом калия. 14 2.2 Гидроксильная группа. 14 2.2.1 Реакция с сероуглеродом и щелочью.. 14 2.2.2 Реакция на фенолы.. 15 2.2.3 Реакция на гликоли и многоатомные спирты.. 16 2.3 Карбонильная группа. 16 2.3.1 Реакция с солянокислым гидроксиламином. 16 2.3.2 Реакции с 2,4-динитрофенилгидразином. 17 2.3.3 Реакция Толленса на альдегидную группу. 17 2.3.4 Реакция с реактивом Фелинга. 17 2.4 Карбоксильная группа. 18 2.4.1 Реакция на кислотность среды.. 18 2.4.2 Реакция с гидрокарбонатом натрия. 18 2.4.3 Качественная реакция a-оксикислот с хлоридом железа (III) 19 2.4.4 Качественная реакция бензойной кислоты с хлоридом железа (III) 19 2.4.5 Обнаружение сложного эфира. 19 2.5 Углеводы.. 19 2.5.1 Реакция на углеводы с a-нафтолом. 19 2.5.2 Реакция Троммера на альдозы.. 20 2.5.3 Реакция Селиванова на кетозы.. 20 2.5.4 Реакция крахмала с йодом. 21 2.5.5 Тонкослойная хроматография сахаров. 22 2.6 Амины.. 22 2.6.1 Обнаружение аминогруппы по реакции с 2,4-динитрохлорбензолом. 22 2.6.2 Исследование основности аминов. 23 2.7 Аминокислоты. Белки. 23 2.7.1 Реакция аминокислот с хлоридом железа (III) 23 2.7.2 Реакция с солями меди. 23 2.7.3 Действие азотистой кислоты на аминокислоты.. 24 2.7.4 Ксантопротеиновая реакция на белки. 24 2.7.5 Биуретовая реакция на белки. 25 2.8 Жиры.. 25 2.8.1 Обнаружение жиров. 26 2.8.2 Определение непредельных кислот в жирах. 26 2.8.3 Определение кислотности жиров. 26
2.8.4 Омыление жира. 27 2.8.5 Определение перекисного числа жира. 27 2.9 Пищевые красители. 28 3 ИНФРАКРАСНАЯ СПЕКТРОСКОПИЯ В АНАЛИЗЕ СТРОЕНИЯ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ.. 29 4 ТОНКОСЛОЙНАЯ ХРОМАТОГРАФИЯ В АНАЛИЗЕ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ.. 31 5 ЯМР-СПЕКТРОСКОПИЯ В АНАЛИЗЕ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ 32 6 ИСПОЛЬЗОВАНИЕ КОНСТАНТ ДЛЯ ИДЕНТИФИКАЦИИ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ.. 35 6.1 Температура плавления. 35 6.2 Температура кипения. 35 6.3 Определение плотности. 36 6.4 Показатель преломления. 36 7 ЗАДАЧА НА ИДЕНТИФИКАЦИЮ НЕИЗВЕСТНОГО ОРГАНИЧЕСКОГО ВЕЩЕСТВА.. 38 7.1 Предварительное исследование вещества. 38 7.2 Качественный анализ. 39 7.3 Открытие функциональных групп. 39 7.3.1 Качественные реакции на кратные углеводородные связи. 40 7.3.2 Открытие ароматических систем. 40 7.3.3 Открытие гидроксильных групп. 40 7.3.4 Открытие альдегидов и кетонов. 41 7.3.5 Открытие карбоновых кислот и их производных. 41 7.3.6 Открытие аминов и аминокислот. 41 7.3.7 Открытие углеводов (моно– и дисахаридов) 42 7.4 Идентификация отдельных соединений. 42 7.4.1 Спирты и фенолы.. 42 7.4.2 Альдегиды и кетоны.. 43 7.4.3 Кислоты.. 43 7.4.4 Амины.. 44 СПИСОК ИСПОЛЬЗОВАННЫХ ИСТОЧНИКОВ И РЕКОМЕНДУЕМОЙ ЛИТЕРАТУРЫ 46
Введение Возможности коренного совершенствования технологии производства и переработки пищевых продуктов предопределяются реализацией входного, пооперационного и выходного аналитического контроля продукции. Важными аналитическими характеристиками пищевых продуктов являются: содержание воды, липидов, углеводов, белков, минеральных солей. Изменение технологических и потребительских свойств пищевых продуктов в процессах их хранения и переработки сопровождаются изменениями интегрального элементного и функционального состава, накоплением новых соединений под влиянием биологических и термических факторов. Изучение сложных биологических комплексов, какими являются пищевые продукты растительного и животного происхождения, осуществляется с использованием методов качественного и количественного анализа. При этом используются классические приемы перевода органических соединений в соответствующие неорганические производные с последующим их анализом, а также современные экспресс-методы, основанные на физико-химических приемах: ультрафиолетовая (УФ), инфракрасная (ИК) и электронная спектроскопия, различные виды хроматографии (тонкослойная (ТСХ), бумажная (БХ), газо-жидкостная (ГЖХ), гель-проникающая (ГП) и др.
Детальный анализ пищевых продуктов позволяет не только повысить эффективность технологических процессов их производства и переработки, но и обеспечить сохранность при хранении, а также повысить потребительскую ценность. Реализации этих задач возможна при условии приобретения необходимых навыков и умений у студентов, изучающий курс «Органическая химия». Элементный анализ органических соединений основан на разложении органического вещества соответствующими неорганическими реагентами при нагревании и идентификации образующихся новых неорганических соединений обычными методами качественного и количественного анализа. Функциональный анализ органических соединений основан на специфических реакциях функциональных групп с органическими реагентами, в результате которых образуются легко идентифицируемые соединения по выпадению осадка, появлению специфического запаха, выделению газа, а также физико-химическими методами. Исключительно надежными и информативными при установлении строения органических соединений зарекомендовали себя хроматографические и спектральные методы. Физико-химические основы, области применения и практические приемы проведения анализа этими методами уже освещались в лекционном курсе, в разработанных на кафедре методических указаниях /1,2/, а также представлены в данном пособии. Методика тонкослойной хроматографии, использованная для разделения и анализа сахаров, для идентификации пищевых красителей, описана в разделах 2.9, 4. Тонкослойная хроматография может быть использована для анализа многих органических соединений: одно- и многоатомных спиртов, карбонильных соединений, карбоновых кислот и их производных, аминов и аминокислот, пептидов, белков, восков, различных консервантов и антиоксидантов /3-8/. В ряде случаев для получения чистых веществ применяют препаративную хроматографию (жидкостную или газовую) /7-11/. При проведении синтезов органических соединений /12/ для подтверждения чистоты, состава и строения получаемых продуктов студенты должны уметь использовать как химические, так и физические (хроматографические и спектральные) методы анализа /13-20/. В данном разделе лабораторного практикума, выполняемого как учебная исследовательская работа, студент должен приобрести знания, навыки и умения выполнения основного элементного и функционального анализа состава органических соединений. В процессе выполнения лабораторного практикума студент все стадии экспериментов отражает в лабораторном рабочем журнале в соответствии с правилами /21/. Дополнительную информацию по функциональному анализу и идентификации органических соединений можно получить в специальных руководствах /22-30/. КАЧЕСТВЕННЫЙ ЭЛЕМЕНТНЫЙ АНАЛИЗ Принадлежность органических веществ к определенным классам соединений, их строение, степень чистоты устанавливается с помощью элементного и функционального анализа. Качественный элементный анализ позволяет определить, из атомов каких элементов построены молекулы органического вещества: количественный элементный анализ устанавливает элементный состав соединения и простейшую формулу.
При выполнении элементного анализа органические вещества «минерализуют», т.е. разлагают таким образом, чтобы углерод превратился в СО2, водород – в Н2О, азот – в N2, NO3– или ионы CN– и т.п. Дальнейшее определение проводят обычными методами аналитической химии. Открытие углерода и водорода в органическом веществе Материалы: какое-либо малолетучее органическое вещество (сахар, нафталин, глицерин и т.п.), оксид меди (в порошке); известковая или баритовая вода (насыщенный раствор Са(ОН)2 или Ва(ОН)2. Методика проведения: 0,2-0,3 г испытуемого жидкого или твердого вещества смешивают с 1-2 г порошка оксида меди на часовом стекле или на бумажке. Смесь пересыпают в сухую пробирку с плотной пробкой и газоотводной трубкой. Пробирку укрепляют в лапке штатива почти горизонтально и конец трубки вводят в другую пробирку, содержащую 2-3 см3 прозрачной известковой или баритовой воды, так, чтобы трубка почти касалась поверхности жидкости. Смесь нагревают сначала осторожно, затем сильнее. Образование воды обнаруживается по появлению капель на холодных стенках пробирки и трубки, а образование углекислого газа – по появлению осадка плохо растворимого углекислого кальция (или бария). Далеко не всегда удается обнаружить путем нагревания (по обугливанию) наличие в органическом веществе углерода, тогда как при прокаливании с оксидом меди весь содержащийся в веществе углерод превращается в СО2, а водород – в Н2О. Оксид меди, окисляя органическое вещество, сам восстанавливается до металлической меди. Этот метод используется как при качественном, так и при количественном элементном анализе органических соединений. Используемое вещество предварительно высушивают для удаления гигроскопической и кристаллизационной воды. Открытие азота, серы и галоидов в органическом веществе Для обнаружения присутствия азота, серы или галоидов обычно необходимо полностью разрушить органическое вещество прокаливанием со щелочью, например с натронной известью. При этом сера и галоиды переходят в неорганические соли – сульфиды и хлориды (бромиды, йодиды), а б о льшая часть азота выделяется в виде аммиака. Все эти образовавшиеся вещества могут быть обнаружены обычными ионными реакциями. Галоиды часто удается отщепить и перевести в соли галогенводородных кислот также действием металлического натрия на спиртовой раствор испытуемого вещества (способ Степанова). Для одновременного открытия азота, серы хлора, брома и йода в органических соединениях удобен предложенный Лассенем метод прокаливания вещества с металлическим натрием. При этом сера и галоиды связываются так же, как и при их прокаливании со щелочью, азот же частично образует с углеродом и натрием цианистую соль:
СnHmNSCl ¾® NaCN + Na2S + NaCl Если в органическом соединении содержится галоген, то образуется легко открываемая обычными методами соответствующая натриевая соль. При содержании в органическом соединении азота образуются цианиды, легко обнаруживаемые по образованию комплексного цианида – берлинской лазури. Если в органическом соединении содержатся азот и сера (что характерно, например, для тиомочевины, а также цистеина), то они легко идентифицируются по появлению красной окраски при добавлении к раствору продуктов прокаливания солей железа (III): это по существу качественная реакция на образование роданид-иона CNS-.
Открытие серы основано на переводе полученного сульфида натрия в нерастворимый в щелочах сернистый свинец буро-черного цвета: Pb(NO3)2 + 4NaOH ¾® 2NaNO3 + 2H2O + Pb(ONa)2 Na2S + Pb(ONa)2 + 2H2O ¾® PbS¯ + 4NaOH Нитропруссид натрия Na2[Fe(CN)5NO] образует с сернистым натрием нестойкое комплексное соединение фиолетового цвета, которому приписывают строение Na2[Fe(CN)5ONSNa]. Если при пробе на галоиды (после прокаливания с натрием) не удалены кипячением с азотной кислотой присутствующие в растворе H2S и HCN, то добавление азотнокислого серебра может дать черный осадок Ag2S или белый осадок AgCN; этот последний по характеру и цвету совершенно схож с хлористым серебром, но не темнеет на свету за несколько минут как AgCl. Перманганат калия в кислой среде окисляет ионы галоидов до свободных галоидов: 2MnO4- + 10I- (Cl-, Br-) + 16H+ ¾® 2Mn2+ + 5I2 (Cl2, Br2) + 8H2O Бром и йод, легко растворяясь в органических растворителях, окрашивают их в характерный цвет. Примечание. Некоторые органические вещества (CH3NO2, CHCl3, CCl4, соли диазония, ди- и тринитросоединения) при прокаливании с металлическим натрием иногда реагируют бурно, со взрывом. Материалы: какое-либо органическое соединение, содержащее указанные элементы (например, анилин, его хлоргидрат, тиомочевина, сульфаниловая кислота, мочевина, йодоформ); натрий металлический; азотнокислый свинец (10%-ный водный раствор); нитропруссид натрия (свежеприготовленный 0,5%-ный водный раствор); сернокислое железо закисное (железный купорос); хлороформ или бензол. Методика проведения: несколько кристаллов или капель исследуемого вещества помещают в узкую пробирку (из стеклянной трубки), держа ее наклонно, и кладут туда же (немного выше) кусочек очищенного от корки и высушенного фильтровальной бумагой металлического натрия размером с пшеничное зерно. Держа пробирку почти горизонтально (в деревянном зажиме), сначала нагревают натрий до его расплавления; затем поворачивают пробирку вертикально, чтобы капля горячего натрия упала на вещество (осторожно, ВСПЫШКА!), после чего нагревают смесь до красного каления. Горячую пробирку быстро опускают в ступку с 5-6 см3 дистиллированной воды так, чтобы пробирка растрескалась. Эту операцию следует проводить за стеклянной дверцей вытяжного шкафа или же работать в защитных очках.
Черные кусочки плава хорошо измельчают пестиком, переливают содержимое ступки в пробирку, нагревают до кипения; отфильтровывают щелочную жидкость через маленький складчатый фильтр и используют ее для проб на серу, азот и галоиды. Жидкость должна быть бесцветной; желтая или коричневая ее окраска указывает на неполноту разрушения исходного вещества. В этом случае опыт надо повторить с новой порцией того же вещества. Проба на серу Методика проведения: А. К 1см3 раствора азотнокислого свинца приливают раствор гидроксида натрия по каплям до растворения первоначально образующегося гидроксида и затем добавляют несколько капель отфильтрованной щелочной жидкости (см. выше). Появление темно-коричневой окраски или образование черного осадка сульфида свинца, ускоряющееся при нагревании, указывает на то, что исследуемое вещество содержало серу. Методика проведения: Б. К 1 см3 отфильтрованной щелочной жидкости добавляют 1-2 капли раствора нитропруссида натрия. В присутствие серы смесь сразу или постепенно приобретает ярко-фиолетовую окраску. Проба на азот Методика проведения: отлив половину полученной фильтрованием щелочной жидкости, добавляют к ней маленький кристаллик железного купороса, кипятят смесь в течение 1-2 минут, охлаждают, дают постоять 3-5 минут и подкисляют разбавленной соляной кислотой. Образование синего осадка берлинской лазури указывает на то, что исходное вещество содержало азот. Если азота мало, то раствор после подкисления окрашивается в зеленый цвет, а синий осадок выделяется лишь спустя некоторое время. Проба на галоиды Методика проведения: вторую половину щелочной жидкости подкисляют концентрированной азотной кислотой. В случае наличия серы или азота необходимо кипятить этот кислый раствор в течение нескольких минут в вытяжном шкафу для удаления сероводорода и синильной кислоты, которые мешают последующей реакции. К части остывшей прозрачной кислой жидкости добавляют несколько капель раствора азотнокислого серебра. Образование тяжелого хлопьевидного осадка указывает на присутствие галоида. Хлористое серебро – белое (затем темнеющее на свету), бромистое – желтоватое, а йодистое – желтое. Если желательно уточнить, присутствует ли бром или йод, то к оставшейся части кислого раствора добавляют 1 см3 хлороформа или бензола и затем при встряхивании 2-3 капли 1%-ного раствора марганцевокислого калия. Дав смеси отстояться, отмечают окраску органического слоя; фиолетовая окраска указывает на присутствие йода, оранжевая или желтая – на присутствие брома. Однако избыток перманганата может обусловить фиолетовую окраску водного слоя, что не следует принимать за положительную реакцию на присутствие йода. Кратная связь Реакция с бромом Подавляющее большинство соединений, содержащих кратную связь (двойную, тройную, их комбинации, за исключением ароматических систем), легко присоединяют бром
Методика проведения: реакцию проводят обычно в уксусной кислоте или четыреххлористом углероде. К раствору 0,1 г или 0,1 см3 вещества в В отдельных случаях соединения, содержащие водород, легко замещающийся на бром (анилин, фенол, некоторые третичные углеводороды), также обесцвечивают раствор брома. Однако при этом выделяется бромистый водород, который легко определяется с помощью влажной лакмусовой бумажки или красителя «конго»:
Тогда реакцию удобнее проводить в ССl4, в котором НВr нерастворим. Гидроксильная группа Реакция на фенолы Большинство фенолов дают интенсивную окраску с раствором хлорида железа (III).:
Обычная окраска раствора синяя или фиолетовая. Но у ряда сложных фенолов она бывает зеленой или красной. Реакцию проводят в водных растворах или в хлороформе, чтобы отличить фенолы от енолов. Последние дают интенсивное окрашивание в метаноле или этаноле. Методика проведения: в пробирке растворяют несколько кристаллов или одну каплю вещества в 1 см3 воды или хлороформа. Встряхивают, добавляют 1 каплю 1%-ного водного раствора FeCl3. В присутствии фенольного гидроксида тотчас же появляется интенсивная окраска. Енолы в этих условиях дают лишь слабое окрашивание. Фенолы четче дают реакцию в присутствии воды. Карбонильная группа Реакция с реактивом Фелинга Альдегиды жирного ряда восстанавливают двухвалентную медь в одновалентную. В качестве реактива, содержащего ионы двухвалентной меди, применяется реактив Фелинга. Его готовят перед употреблением, смешивая
Ароматические альдегиды эту реакцию не дают. Методика проведения: приготавливают в пробирке реактив Фелинга, сливая по 1 см3 исходных растворов, и прибавляют 2 см3 1%-ного раствора глюкозы. Верхнюю часть содержимого пробирки нагревают в пламени горелки до начала кипения и наблюдают появление желтого или красного осадка оксида меди (I). Параллельно проводят реакцию с формалином и бензальдегидом, прибавляя к 2 см3 реактива Фелинга (по отдельности) по 2-3 капли формалина и 1-2 капли бензальдегида. Наблюдают происходящие изменения. Карбоксильная группа Обнаружение сложного эфира Методика проведения: к раствору 100-500 мг сложного эфира в 3-5 см3 спирта приливают несколько капель раствора фенолфталеина и прибавляют по каплям 0,5н спиртовой раствор гидроксида калия. Возникшая в начале красная окраска вскоре исчезает. Эта проба на омыление дает положительный результат не только для сложных эфиров, но и для лактонов, ангидридов.
Углеводы 2.5.1 Реакция на углеводы с a-нафтолом (реакция Молиша) При действии серной кислоты на самые различные углеводы (кроме моносахаридов) первоначально идет гидролиз. Образующийся моносахарид конденсируется в 5-гидроксиметилфурфурол. Последний конденсируется с двумя молекулами a-нафтола в хиноидную структуру, подвергающуюся сульфированию. Образуется ярко окрашенное красно-фиолетовое соединение хиноидного типа. Методика проведения: в 1 см3 воды вносят 0,01 г углевода (или сырья, содержащего углевод) и 2 капли свежеприготовленного 10%-ного спиртового раствора a-нафтола. Смесь слегка мутнеет из-за выпадения a-нафтола. Осторожно из пипетки по стенкам пробирки приливают 1 см3 концентрированной серной кислоты так, чтобы она опустилась на дно, не смешавшись с водным слоем. При наличии в исследуемом веществе углеводов на границе слоев появляется красно-фиолетовое кольцо. Реакция очень чувствительна, и необходимо следить, чтобы в реакционную смесь не попали углеводные загрязнения. Реакция Троммера на альдозы Методика проведения: в пробирку наливают 1 см3 1%-ного водного раствора глюкозы, 1 см3 2н раствора гидроксида натрия и 2 капли 5%-ного раствора сульфата меди. Выпадающий гидроксид меди быстро растворяется в темно-синий раствор за счет возникновения хелатов меди по расположенным рядом гидроксигруппам (см. 2.2.3). Медленно нагревают верхнюю часть пробирки на спиртовке до начала кипения. Синий цвет исчезает, выделяется желтый или красно-коричневый осадок оксида меди (I), (см. 2.3.4). Если для опыта взять невосстанавливающий дисахарид, например, сахарозу, то изменение окраски не происходит.
Кислотный гидролиз сахарозы С целью получения глюкозы и фруктозы проводят кислотный гидролиз сахарозы. Молекула сахарозы легко расщепляется при гидролизе на молекулу глюкозы и молекулу фруктозы. Оба моносахарида входят в состав сахарозы в циклических формах. В создании связи между ними участвуют оба гликозидных гидроксила. В сахарозе остаток фруктозы находится в виде непрочного 5-членного цикла – фуранозы; такие сложные сахара очень легко гидролизуются. Химизм процесса:
Методика проведения: в пробирку наливают две капли 1%-ного водного раствора сахарозы, 2 капли 2н соляной кислоты, 5 капель воды и осторожно нагревают над пламенем горелки 20-30 минут. Полученный раствор разливают на две пробирки, в которых открывают глюкозу и фруктозу. Реакция крахмала с йодом Методика проведения: в пробирку помещают 2 капли 2%-ного крахмального клейстера и 1 каплю 0,1н водного раствора йода. Содержимое пробирки окрашивается в синий цвет. Полученную темно-синюю жидкость нагревают до кипения. Окраска при этом исчезает, но при охлаждении появляется вновь. Крахмал является неоднородным соединением. Он представляет собой смесь двух полисахаридов – амилозы (20%) и амилопектина (80%). Амилоза растворима в теплой воде и дает с йодом синее окрашивание. И амилоза, и амилопектин состоят из остатков глюкозы, связанных a-гликозидными связями; но они отличаются формой молекул. Амилоза представляет собой линейный полисахарид, построенный из нескольких тысяч остатков глюкозы, обладающий структурой спирали. Внутри спирали остается свободный канал диаметром около 5 мк, в который могут внедряться молекулы, образуя особого типа комплексы – так называемые соединения включения (клатраты). Одним из них является соединение амилозы с йодом, имеющее синее окрашивание. Строение амилозы схематически выражается следующей формулой:
Амилопектин в теплой воде нерастворим, набухает в ней, образуя крахмальный клейстер. В состав амилопектина, в отличие от амилозы, входят разветвленные цепи гликозных остатков. Амилопектин с йодом дает красновато-фиолетовое окрашивание. Амины 2.6.1 Обнаружение аминогруппы по реакции с В бесцветном 2,4-динитрохлорбензоле атом хлора весьма подвижен и в мягких условиях реагирует с аминами, образуя окрашенные в желтый цвет продукты конденсации:
Реакция происходит только со свободными основаниями. Методика проведения: к 1-2 каплям исследуемого эфирного раствора вещества в пробирке прибавляют 1-2 капли 1%-ного эфирного раствора Аминокислоты. Белки 2.7.1 Реакция аминокислот с FeCl3 При действии FeCl3 в водных растворах на аминокислоты образуются хелаты, окрашенные в красный цвет:
От минеральных кислот окраска исчезает. Методика проведения: к 0,05 г a-аминокислоты, растворенной в 1 см3 воды, добавляют каплю 3%-ного раствора FeCl3. Возникшая окраска доказывает присутствие аминокислот. Реакция с солями меди В слабокислых средах аминокислоты дают с солями меди ярко-синие хелаты:
Для сдвига равновесия вправо ее лучше проводить в буферном растворе с добавкой ацетата натрия. Методика проведения: в 1 см3 1%-ного раствора аминокислоты вносят кристаллик медного купороса и кристаллик ацетата натрия. В присутствии аминокислоты раствор становится густо-синим. Биуретовая реакция на белки Методика проведения: в пробирку с 3 см3 раствора альбумина вливают
Продукты распада белка – полипептиды – также дают биуретовую реакцию. Цвет образующихся медных комплексов определяется числом аминокислот, связанных пептидной связью. Дипептиды дают синюю окраску, трипептиды – фиолетовую, а тетрапептиды и более сложные пептиды – красную, фиолетовый цвет медного комплекса с белком в условиях биуретовой реакции указывает на преобладание в сложной белковой частице трипептидных группировок (это подтверждается и другими данными). Некоторые атомные группы, например,
Жиры Жиры представляют собой сложные эфиры глицерина и жирных кислот как средней, так и большой молекулярной массы. В жирах всегда присутствует небольшое количество свободных кислот и незначительное количество неомыляемых составных частей. Обнаружение жиров Реакцией на присутствие жира служит акролеиновая проба, которой открывают в жирах глицериновый остаток. При нагревании жира глицериновый остаток частично переходит в глицерин, который теряет воду и образует акролеин, легко обнаруживаемый по специфическому раздражающему запаху. Воски, в отличие от жиров, такой реакции не дают. Методика проведения: в сухую пробирку помещают 1-2 капли жира, добавляют двойное количество (по объему) сухого гидросульфата калия и нагревают содержимое до появления белых густых паров. Резкий, раздражающий запах говорит об образовании акролеина:
Омыление жира Омыление жира проводят спиртовым или водным раствором щелочи. Методика получения и качественные реакции на мыла представлены в /14/. Пищевые красители В качестве пищевых применяются следующие пищевые природные красители: красные – ализарин, синий сандал, катеху, кошениль, алканлин, лакмус, пурпурин; желтые – β-каротин, куркума, настойка жостера, рибофлавин, биксин, кеатофилл; синий – индигокармин; зелены й – хлорофилл; коричневый – жженый сахар. Целесообразнее всего идентифицировать эти красители при помощи хроматографии. Для разделения на бумаге используют 1-2% растворы красителей в смеси 2н соляной кислоты с метиловым спиртом (2:1), а для тонкослойной хроматографии – 0,1-0,15% растворы, которые наносят на расстоянии 1,5 см от края пластинки так, чтобы диаметр пятна не превышал 2 см. При тонкослойной хроматографии в качестве адсорбента используют целлюлозу, в качестве подвижных растворителей следующие системы: 1) 2,5% раствор цитрата натрия – 25% аммиак (4:1); 2) пропиловый спирт – этилацетат – вода (6:1:3), (система применяется при хроматографии на бумаге); 3) пропиловый спирт – 2н аммиак (6:4); 4) 2 г трехзамещенного цитрата натрия в 100 см3 5%-ного раствора аммиака. Для разделения природных красителей – биксина, каротина, кажантина, куркумина и кроцеина – растворы этих веществ наносят в спирте или хлороформе и хроматографируют в системе хлороформ – уксусный ангидрид (25:2). Для разделения ряда красителей, применяемых в медицине, на пластинках с силикагелем пригодна система хлороформ – ацетон – изопропиловый спирт – 5-6% сернистая кислота (3:4:2:1). Красители наносят в виде растворов в 0,25% метиловом спирте, диаметр пятен на старте 2 мм (см. таблицу 1). Таблица 1 – Значения фактора задержки (Rf) для некоторых красителей
Дополнительную информацию о хроматографии некоторых синтетических красителей можно получить из разработанного на кафедре методического указания /I/ и специальных руководств /6-9/.
Температура плавления Для характеристики твердого органического вещества часто в качестве критерия чистоты пользуются температурой плавления (Тпл). Органическое вещество считают чистым, если оно имеет четко выраженную температуру плавления, т.е. плавится в интервале не более одного градуса. Примеси в веществе сильно понижают температуру плавления. Этим свойством пользуются для установления идентичности двух веществ, имеющих равные или близкие температуры плавления. Для этого тщательно смешивают равные количества двух веществ (смешанная проба) и определяют температуру плавления этой смеси. Если температура смеси остается неизменной по сравнению с температурой плавления каждого компонента, то делают заключение об идентичности испытуемого вещества. Понижение температуры плавления смешанной пробы по сравнению с исходными компонентами, т.н. депрессия температуры плавления, указывает на присутствие двух разных веществ. Методика определения температуры плавления представлена в методическом пособии /32/ и других специальных руководствах /27-31/. Температура кипения Температура кипения (Ткип) является важнейшей характеристикой вещества. Для ее определения вещество перегоняют. За температуру кипения принимают такую температуру, при которой давление пара жидкости над ее поверхностью равно атмосферному давлению. Температура кипения является функцией давления, поэтому при перегонке необходимо знать показания барометра (манометра). Влияние загрязнений на температуру кипения в большей степени зависит от характера примесей. Легколетучие вещества понижают температуру кипения, а примесь с той же самой температурой кипения, что и основное вещество, не изменяет температуру его кипения. Точную температуру кипения определяют эбуллиометрами. Принцип их действия основан на следующем. Жидкость нагревают до кипения в приборе с обратным холодильником и измеряют температуру. При работе с небольшим количеством вещества определяют температуру кипения в капилляре (по Сиволобову), который прикрепляют к термометру резиновым колечком и помещают в прибор для определения температуры плавления. Прибор нагревают, жидкость в капилляре закипает, выделяются пузырьки. Затем нагревание прекращают, и температура, при которой происходит внезапное прекращение выделения пузырьков, и есть температура кипения. Определение плотности Плотность (r или d) – одна из характерных констант чистого вещества. Она меняется с изменением температуры. Чаще всего определяют относительную плотность. Как правило, в качестве стандарта служит вода при 4°С, плотность которой в этих условиях приближается к единице (r = 0,999997 г/см3). Поэтому стандартную плотность при определенной температуре, отнесенную к плотности воды при 4°С, обозначают как Плотность определяют, применяя весы Мора или Вестфаля, ареометр либо пикнометр. В продаже имеются готовые комплекты ареометров, градуированные при определенной температуре. Сухой ареометр свободно помещают в исследуемую жидкость при температуре, указанной на ареометре; плотность отсчитывают непосредственно по шкале ареометра. Способ определения плотности в пикнометре основан на измерении массы известного объема жидкости. Вначале взвешивают пустой пикнометр, потом с водой, а затем с исследуемой жидкостью. Находят массу равных объемов исследуемой жидкости и воды. Вычислив отношение этих масс, получают относительную плотность. Сопоставив полученную величину относительной плотности (r) со справочным значением, делают вывод о чистоте полученного соединения или его тождестве с известным веществом. Дополнительную информацию об измерении относительной плотности с помощью пикнометров можно получить в руководствах /26-32/. Показатель преломления Используется для идентификации и проверки чистоты жидкостей. Сопоставляя измеренную величину показателя преломления со справочным значением можно сделать вывод о чистоте полученного соединения или о его тождестве с известным веществом. Величина показателя преломления изменяется с изменением температуры и длины волны света, при которых производится определение. Как правило, значение показателя преломления находят при длине волны, соответствующей длине волны желтого натриевого пламени (D-линия, Показатель преломления определяют рефрактометрами – рефрактометр типа Аббе. Они сконструированы так, что при любом типе освещения отмечают показатель преломления для D-линии Na. Для измерения н
|
|||||||||||||||
|
Последнее изменение этой страницы: 2016-09-19; просмотров: 154; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.137.199.190 (0.02 с.) |

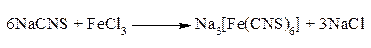

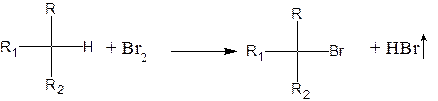
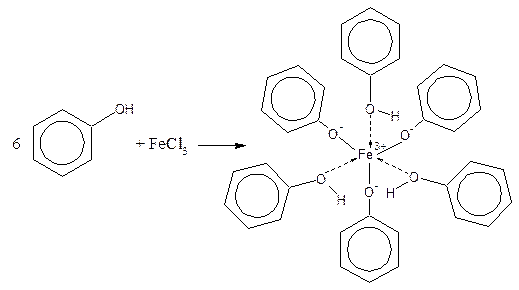
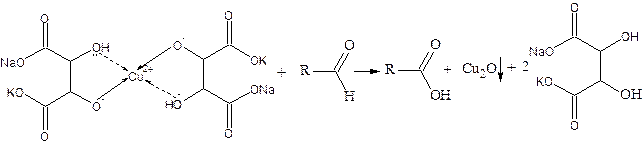
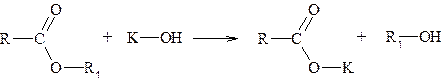
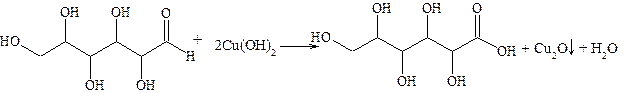
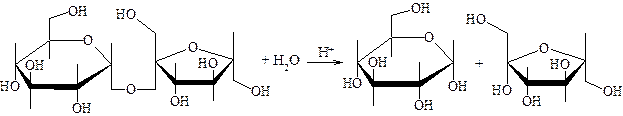


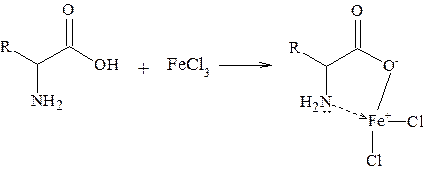
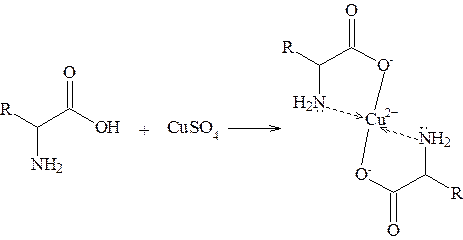
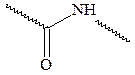
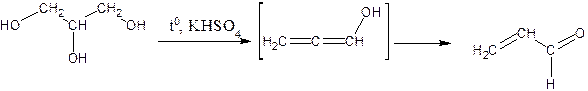
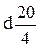 .
.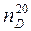 показывает, что показатель преломления определен для линии D при 20°С. Для органических жидкостей показатель преломления изменяется обычно в пределах от 1,3 до 1,8.
показывает, что показатель преломления определен для линии D при 20°С. Для органических жидкостей показатель преломления изменяется обычно в пределах от 1,3 до 1,8.


