
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Ямр-спектроскопия в анализе органических соединенийСодержание книги
Поиск на нашем сайте
Спектроскопия ядерного магнитного резонанса (ЯМР) является наиболее мощным методом физико-химического исследования органических соединений. С помощью ЯМР-спектроскопии можно решать те же задачи, что и с помощью ИК- и УФ-спектроскопии: определять структуру органических соединений, проводить кинетические измерения, решать задачи количественного и качественного анализа. Наибольшее применение получил протонный магнитный резонанс (ПМР) – резонанс на ядрах водорода, поскольку этот вид ЯМР применяется наиболее широко. Ядро атома водорода (протон) обладает магнитным моментом. Если протон попадает в постоянное магнитное поле, то магнитный момент его может быть направлен или по направлению внешнего магнитного поля или против; в первом случае его спин равен минус 1/2, во втором +1/2. Расположение по направлению магнитного поля энергетически несколько более выгодно, и, чтобы расположиться против направления магнитного поля, ядро должно получить определенный квант энергии, который обозначают ∆E. Поэтому, если дополнительно воздействовать на протон излучением с такой частотой, чтобы соблюдать равенство ∆E = hν (h – постоянная Планка), то будет происходить резонансное поглощение этого излучения и изменение ориентации его магнитного спина; в спектре появится сигнал протонного резонанса данного типа атомов, т.е. пик поглощения на регистраторе резонанса. В зависимости от окружения, в котором находятся ядра водорода, сигнал протонного магнитного резонанса может находиться при различных значениях резонансной чистоты. Меняя радиочастоту в области всего спектра, мы получим своеобразную «фотографию» всех протонов, содержащихся в веществе, и изображенную пиками поглощения в спектре. Спектрометр ПМР имеет мощный магнит, способный создать однородное магнитное поле напряженностью от 10000 и более эрстед. Между полюсами этого магнита помещается ампула с образцом. Для устранения флуктуаций в однородности поля ампула быстро вращается. Имеется генератор радиоизлучения, которое направлено перпендикулярно магнитному полю. Спектр записывается регистратором резонанса. Принято характеризовать спектрометры ПМР по рабочей частоте генератора резонанса, которая связана с напряженностью магнитного поля прямой пропорциональной зависимостью. Выпускают спектрометры с рабочей частотой 80, 100, 200, 300 мегагерц (МГц), следовательно, с длиной волны 5,3, 1,5 и 1м. Таким образом, для облучения вещества в ЯМР-спектрометрах используются радиоволны. Основное уравнение протонного магнитного резонанса имеет вид:
где Н0 – напряженность магнитного поля; ν – частота излучения; μ – магнитный момент ядра, равный для протона 2,7927; h – постоянная Планка; d – константа экранирования, которая характеризует величину локальных магнитных полей, экранирующих ядро. Чем больше электронная плотность у ядра, тем более сильные локальные магнитные поля возникают, они экранируют ядро от действия приложенного магнитного поля Н0. При этом резонансный сигнал наблюдается в более сильных полях. Величина возникающих локальных магнитных полей зависит от заместителей у ближайшего углеродного атома, а также от строения более удаленных частей молекулы. Чем сильнее оттянуты электроны от протона, тем в более слабых полях (т.е. левее в спектре) наблюдается его резонансная частота в виде пика поглощения. Положение сигнала протонного магнитного резонанса измеряется по отношению к какому-либо эталону. Международным эталоном является тетраметилсилан (ТМС) – (СН3)4Si, сигнал которого наблюдается в сильном поле, так как кремний более электроположителен, чем углерод, и поэтому электронная плотность в месте нахождения протонов у данного соединения велика. Большинство других органических соединений имеют сигналы в более слабых полях. Расстояние сигнала протонов вещества от сигнала эталона называется химическим сдвигом. Химический сдвиг – одна из основных характеристик спектров ПМР. Величина химического сдвига чаще всего обозначается d и может быть выражена в герцах. Однако эта величина зависит от прибора, на котором получен спектр ПМР. Для того чтобы иметь возможность сравнить результаты, полученные на различных приборах, величину химического сдвига измеряют в относительных единицах, получивших название «миллионные доли» (м. д.). Химический сдвиг, выраженный в миллионных долях, определяется как разность между положением сигналов образца и эталона (nобр. – nэт), выраженная в единицах частоты – герцах, – деленная на рабочую частоту прибора n0; эта величина умножается еще на 106:
В шкале d сигнал тетраметилсилана принят за 0 (nтмс = 0) и значения химических сдвигов, выраженные в м. д., увеличиваются в сторону более слабых полей. Химические сдвиги различного типа протонов даны в таблице 3. Таблица 3 – Химический сдвиг сигналов протонов, м.д.
Интенсивность резонансного пика всегда пропорциональна числу эквивалентных протонов, обусловивших появление этого пика. Поэтому по химическому сдвигу и относительной интенсивности линий в спектре ПМР можно сказать, сколько и каких протонов содержится в молекуле органического соединения. Если в соединении имеется несколько типов различных протонов, то в ПМР-спектре возникает несколько сигналов. Интегральная интенсивность сигналов (определяемая как площадь под кривой) пропорциональна числу протонов каждого вида. Если мы наблюдаем резонансный сигнал определенных протонов, например, групп –СН3, =СН2, ºСН, а у соседних атомов углерода, находится n эквивалентных протонов, то резонансный сигнал протонов этих групп расщепляется на (n+1) линий – спин-спиновое расщепление. Расстояние между всеми соседними линиями в расщепленном сигнале одинаково, обычно оно выражается в герцах (Гц), не зависит от рабочей частоты спектрометра и называется константой спин-спинового расщепления (взаимодействия) и обозначается буквой J. Это явление вызвано взаимодействием спинов неэквивалентных протонов через валентные электроны. Величина константы J зависит от количества и характера связей между взаимодействующими ядрами и от структуры молекулы. Хотя спин-спиновое расщепление и усложняет картину спектра, мультиплетность (сложность) сигнала дает дополнительную и весьма ценную информацию о характере расположенных рядом групп протонов. Для съемки спектра ПМР обычно берут 5-15%-ный раствор вещества в растворителях, как правило, не имеющих своих протонов, чтобы не усложнять картину спектра (ССl4, СS2). Часто применяется дейтерированные растворители – дейтерохлороформ (CDCl3), дейтерометанол (CD3OD), дейтеробензол (C6D6), дейтероуксусная кислота (CD3COOD) и др.). В раствор прибавляют каплю тетраметилсилана в качестве внутреннего стандарта. Дополнительную информацию об использовании спектров ПМР и анализе органических соединений можно получить в специальных руководствах /20, 21, 27/, учебниках и практикумах по органической химии /28-32/. 6 ИСПОЛЬЗОВАНИЕ КОНСТАНТ ДЛЯ ИДЕНТИФИКАЦИИ Каждое органическое соединение характеризуется постоянными физическими свойствами в определенных условиях (температура и давление). Из этих физических свойств легче всего определяются и, как правило, приводятся в химической литературе при описании отдельных соединений следующие: температура плавления, температура кипения, показатель преломления, плотность, молекулярная рефракция, УФ–, ИК– и ЯМР-спектры. Наиболее простым и удобным способом контроля наличия примесей в полученном соединении или установлении тождества неизвестного соединения с известным (идентификация) является сопоставление его физических констант с их справочными значениями. В случае отсутствия справочных данных о чистоте продукта можно судить по достижению неизменных значений физических констант в процессе многократно повторяемых циклов очистки. Абсолютно чистое вещество можно представить себе только теоретически. В практике чистое вещество характеризуется содержанием примесей ниже определенного предела. Этот предел, как правило, составляет доли процента и менее. Получить особо чистое вещество – чрезвычайно сложная и важная технологическая задача, решенная пока для немногих веществ. Температура плавления Для характеристики твердого органического вещества часто в качестве критерия чистоты пользуются температурой плавления (Тпл). Органическое вещество считают чистым, если оно имеет четко выраженную температуру плавления, т.е. плавится в интервале не более одного градуса. Примеси в веществе сильно понижают температуру плавления. Этим свойством пользуются для установления идентичности двух веществ, имеющих равные или близкие температуры плавления. Для этого тщательно смешивают равные количества двух веществ (смешанная проба) и определяют температуру плавления этой смеси. Если температура смеси остается неизменной по сравнению с температурой плавления каждого компонента, то делают заключение об идентичности испытуемого вещества. Понижение температуры плавления смешанной пробы по сравнению с исходными компонентами, т.н. депрессия температуры плавления, указывает на присутствие двух разных веществ. Методика определения температуры плавления представлена в методическом пособии /32/ и других специальных руководствах /27-31/. Температура кипения Температура кипения (Ткип) является важнейшей характеристикой вещества. Для ее определения вещество перегоняют. За температуру кипения принимают такую температуру, при которой давление пара жидкости над ее поверхностью равно атмосферному давлению. Температура кипения является функцией давления, поэтому при перегонке необходимо знать показания барометра (манометра). Влияние загрязнений на температуру кипения в большей степени зависит от характера примесей. Легколетучие вещества понижают температуру кипения, а примесь с той же самой температурой кипения, что и основное вещество, не изменяет температуру его кипения. Точную температуру кипения определяют эбуллиометрами. Принцип их действия основан на следующем. Жидкость нагревают до кипения в приборе с обратным холодильником и измеряют температуру. При работе с небольшим количеством вещества определяют температуру кипения в капилляре (по Сиволобову), который прикрепляют к термометру резиновым колечком и помещают в прибор для определения температуры плавления. Прибор нагревают, жидкость в капилляре закипает, выделяются пузырьки. Затем нагревание прекращают, и температура, при которой происходит внезапное прекращение выделения пузырьков, и есть температура кипения. Определение плотности Плотность (r или d) – одна из характерных констант чистого вещества. Она меняется с изменением температуры. Чаще всего определяют относительную плотность. Как правило, в качестве стандарта служит вода при 4°С, плотность которой в этих условиях приближается к единице (r = 0,999997 г/см3). Поэтому стандартную плотность при определенной температуре, отнесенную к плотности воды при 4°С, обозначают как Плотность определяют, применяя весы Мора или Вестфаля, ареометр либо пикнометр. В продаже имеются готовые комплекты ареометров, градуированные при определенной температуре. Сухой ареометр свободно помещают в исследуемую жидкость при температуре, указанной на ареометре; плотность отсчитывают непосредственно по шкале ареометра. Способ определения плотности в пикнометре основан на измерении массы известного объема жидкости. Вначале взвешивают пустой пикнометр, потом с водой, а затем с исследуемой жидкостью. Находят массу равных объемов исследуемой жидкости и воды. Вычислив отношение этих масс, получают относительную плотность. Сопоставив полученную величину относительной плотности (r) со справочным значением, делают вывод о чистоте полученного соединения или его тождестве с известным веществом. Дополнительную информацию об измерении относительной плотности с помощью пикнометров можно получить в руководствах /26-32/. Показатель преломления Используется для идентификации и проверки чистоты жидкостей. Сопоставляя измеренную величину показателя преломления со справочным значением можно сделать вывод о чистоте полученного соединения или о его тождестве с известным веществом. Величина показателя преломления изменяется с изменением температуры и длины волны света, при которых производится определение. Как правило, значение показателя преломления находят при длине волны, соответствующей длине волны желтого натриевого пламени (D-линия, Показатель преломления определяют рефрактометрами – рефрактометр типа Аббе. Они сконструированы так, что при любом типе освещения отмечают показатель преломления для D-линии Na. Для измерения нужны лишь несколько капель жидкости, точность измерения = 0, 0001. Значение показателя преломления используется также для нахождения величины молекулярной рефракции МR, являющейся важной характеристикой вещества:
где n – показатель преломления; М – молекулярная масса; r – плотность вещества. Молекулярную рефракцию, вычисленную по формуле, сравнивают с молекулярной рефракцией, найденной как сумма атомных рефракций или рефракций связей по табличным данным в соответствии с гипотетической формулой исследуемого вещества /33/. Достаточно удовлетворительное совпадение найденных в обоих случаях значений служит подтверждением правдивости представлений о составе и строении исследуемого вещества, составленных на основании данных химического анализа и изучения химических свойств.
|
||||||||||
|
Последнее изменение этой страницы: 2016-09-19; просмотров: 105; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.21.105.46 (0.012 с.) |

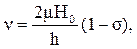
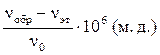
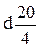 .
.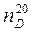 показывает, что показатель преломления определен для линии D при 20°С. Для органических жидкостей показатель преломления изменяется обычно в пределах от 1,3 до 1,8.
показывает, что показатель преломления определен для линии D при 20°С. Для органических жидкостей показатель преломления изменяется обычно в пределах от 1,3 до 1,8.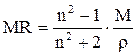 ,
,


