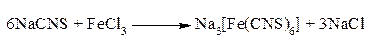Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Отношение органического вещества к нагреваниюСодержание книги Похожие статьи вашей тематики
Поиск на нашем сайте
Материалы: какие-либо малолетучие или нелетучие органические вещества (сахар, глицерин, бензойная кислота, винная кислота, лимонная кислота, натриевые или кальциевые соли органических кислот и т.п.). Методика проведения: небольшое количество (~ 0,2 г) вещества помещают в маленькую фарфоровую чашечку. Нагревают чашечку с веществом в вытяжном шкафу – на треугольнике в кольце штатива либо в щипцах – сначала осторожно, затем сильнее и наблюдают: плавится ли вещество, улетучивается ли, горючи ли его пары, бесцветное или коптящее пламя, образуются ли при горении пары воды (конденсирующиеся на поднесенной к пламени холодной пробирке). Если вещество не улетучивается полностью, усиливают нагревание остатка до его потемнения (обугливания) и прокаливают его до последующего побеления. Дают чашечке охладиться, добавляют к остатку от прокаливания несколько капель воды, перемешивают палочкой и помещают каплю жидкости на красную лакмусовую бумажку. Если остаток не растворился в воде, то испытывают растворимость его в соляной кислоте, добавляя несколько капель кислоты при помешивании. Органические соединения, не содержащие металлов, при нагревании обычно улетучиваются или разлагаются (обугливаются), но затем при прокаливании сгорают полностью. В данном опыте обнаруживается, способно ли вещество кипеть при атмосферном давлении или плавиться без разложения. Сильно коптящее пламя горячих паров вещества указывает на высокое процентное содержание углерода, т.е. заставляет предполагать наличие кратных связей, бензольных колец или длинных углеродных цепей. Образование паров воды обнаруживает наличие водорода в молекуле вещества (см. следующий опыт). При сильном прокаливании солеобразных органических соединений, содержащих металлы (соли кислот, феноляты и т.п.), образуются нелетучие карбонаты щелочных металлов (K, Na) либо оксиды щелочноземельных металлов (Са, Ва, а также Mg). Все эти продукты прокаливания с водой дают щелочную реакцию и полностью растворимы в соляной кислоте; наличие нерастворимого в ней остатка указывает на присутствие в испытуемом веществе тяжелых металлов. Некоторые металлоорганические соединения (например, тетраэтилсвинец) при нагревании в описанных условиях улетучивается без остатка, не разлагаясь; это характерно для веществ, содержащих металл, непосредственно связанный с углеродом органической молекулы. Открытие углерода и водорода в органическом веществе Материалы: какое-либо малолетучее органическое вещество (сахар, нафталин, глицерин и т.п.), оксид меди (в порошке); известковая или баритовая вода (насыщенный раствор Са(ОН)2 или Ва(ОН)2. Методика проведения: 0,2-0,3 г испытуемого жидкого или твердого вещества смешивают с 1-2 г порошка оксида меди на часовом стекле или на бумажке. Смесь пересыпают в сухую пробирку с плотной пробкой и газоотводной трубкой. Пробирку укрепляют в лапке штатива почти горизонтально и конец трубки вводят в другую пробирку, содержащую 2-3 см3 прозрачной известковой или баритовой воды, так, чтобы трубка почти касалась поверхности жидкости. Смесь нагревают сначала осторожно, затем сильнее. Образование воды обнаруживается по появлению капель на холодных стенках пробирки и трубки, а образование углекислого газа – по появлению осадка плохо растворимого углекислого кальция (или бария). Далеко не всегда удается обнаружить путем нагревания (по обугливанию) наличие в органическом веществе углерода, тогда как при прокаливании с оксидом меди весь содержащийся в веществе углерод превращается в СО2, а водород – в Н2О. Оксид меди, окисляя органическое вещество, сам восстанавливается до металлической меди. Этот метод используется как при качественном, так и при количественном элементном анализе органических соединений. Используемое вещество предварительно высушивают для удаления гигроскопической и кристаллизационной воды. Открытие азота, серы и галоидов в органическом веществе Для обнаружения присутствия азота, серы или галоидов обычно необходимо полностью разрушить органическое вещество прокаливанием со щелочью, например с натронной известью. При этом сера и галоиды переходят в неорганические соли – сульфиды и хлориды (бромиды, йодиды), а б о льшая часть азота выделяется в виде аммиака. Все эти образовавшиеся вещества могут быть обнаружены обычными ионными реакциями. Галоиды часто удается отщепить и перевести в соли галогенводородных кислот также действием металлического натрия на спиртовой раствор испытуемого вещества (способ Степанова). Для одновременного открытия азота, серы хлора, брома и йода в органических соединениях удобен предложенный Лассенем метод прокаливания вещества с металлическим натрием. При этом сера и галоиды связываются так же, как и при их прокаливании со щелочью, азот же частично образует с углеродом и натрием цианистую соль: СnHmNSCl ¾® NaCN + Na2S + NaCl Если в органическом соединении содержится галоген, то образуется легко открываемая обычными методами соответствующая натриевая соль. При содержании в органическом соединении азота образуются цианиды, легко обнаруживаемые по образованию комплексного цианида – берлинской лазури. Если в органическом соединении содержатся азот и сера (что характерно, например, для тиомочевины, а также цистеина), то они легко идентифицируются по появлению красной окраски при добавлении к раствору продуктов прокаливания солей железа (III): это по существу качественная реакция на образование роданид-иона CNS-.
Открытие серы основано на переводе полученного сульфида натрия в нерастворимый в щелочах сернистый свинец буро-черного цвета: Pb(NO3)2 + 4NaOH ¾® 2NaNO3 + 2H2O + Pb(ONa)2 Na2S + Pb(ONa)2 + 2H2O ¾® PbS¯ + 4NaOH Нитропруссид натрия Na2[Fe(CN)5NO] образует с сернистым натрием нестойкое комплексное соединение фиолетового цвета, которому приписывают строение Na2[Fe(CN)5ONSNa]. Если при пробе на галоиды (после прокаливания с натрием) не удалены кипячением с азотной кислотой присутствующие в растворе H2S и HCN, то добавление азотнокислого серебра может дать черный осадок Ag2S или белый осадок AgCN; этот последний по характеру и цвету совершенно схож с хлористым серебром, но не темнеет на свету за несколько минут как AgCl. Перманганат калия в кислой среде окисляет ионы галоидов до свободных галоидов: 2MnO4- + 10I- (Cl-, Br-) + 16H+ ¾® 2Mn2+ + 5I2 (Cl2, Br2) + 8H2O Бром и йод, легко растворяясь в органических растворителях, окрашивают их в характерный цвет. Примечание. Некоторые органические вещества (CH3NO2, CHCl3, CCl4, соли диазония, ди- и тринитросоединения) при прокаливании с металлическим натрием иногда реагируют бурно, со взрывом. Материалы: какое-либо органическое соединение, содержащее указанные элементы (например, анилин, его хлоргидрат, тиомочевина, сульфаниловая кислота, мочевина, йодоформ); натрий металлический; азотнокислый свинец (10%-ный водный раствор); нитропруссид натрия (свежеприготовленный 0,5%-ный водный раствор); сернокислое железо закисное (железный купорос); хлороформ или бензол. Методика проведения: несколько кристаллов или капель исследуемого вещества помещают в узкую пробирку (из стеклянной трубки), держа ее наклонно, и кладут туда же (немного выше) кусочек очищенного от корки и высушенного фильтровальной бумагой металлического натрия размером с пшеничное зерно. Держа пробирку почти горизонтально (в деревянном зажиме), сначала нагревают натрий до его расплавления; затем поворачивают пробирку вертикально, чтобы капля горячего натрия упала на вещество (осторожно, ВСПЫШКА!), после чего нагревают смесь до красного каления. Горячую пробирку быстро опускают в ступку с 5-6 см3 дистиллированной воды так, чтобы пробирка растрескалась. Эту операцию следует проводить за стеклянной дверцей вытяжного шкафа или же работать в защитных очках. Черные кусочки плава хорошо измельчают пестиком, переливают содержимое ступки в пробирку, нагревают до кипения; отфильтровывают щелочную жидкость через маленький складчатый фильтр и используют ее для проб на серу, азот и галоиды. Жидкость должна быть бесцветной; желтая или коричневая ее окраска указывает на неполноту разрушения исходного вещества. В этом случае опыт надо повторить с новой порцией того же вещества. Проба на серу Методика проведения: А. К 1см3 раствора азотнокислого свинца приливают раствор гидроксида натрия по каплям до растворения первоначально образующегося гидроксида и затем добавляют несколько капель отфильтрованной щелочной жидкости (см. выше). Появление темно-коричневой окраски или образование черного осадка сульфида свинца, ускоряющееся при нагревании, указывает на то, что исследуемое вещество содержало серу. Методика проведения: Б. К 1 см3 отфильтрованной щелочной жидкости добавляют 1-2 капли раствора нитропруссида натрия. В присутствие серы смесь сразу или постепенно приобретает ярко-фиолетовую окраску. Проба на азот Методика проведения: отлив половину полученной фильтрованием щелочной жидкости, добавляют к ней маленький кристаллик железного купороса, кипятят смесь в течение 1-2 минут, охлаждают, дают постоять 3-5 минут и подкисляют разбавленной соляной кислотой. Образование синего осадка берлинской лазури указывает на то, что исходное вещество содержало азот. Если азота мало, то раствор после подкисления окрашивается в зеленый цвет, а синий осадок выделяется лишь спустя некоторое время. Проба на галоиды Методика проведения: вторую половину щелочной жидкости подкисляют концентрированной азотной кислотой. В случае наличия серы или азота необходимо кипятить этот кислый раствор в течение нескольких минут в вытяжном шкафу для удаления сероводорода и синильной кислоты, которые мешают последующей реакции. К части остывшей прозрачной кислой жидкости добавляют несколько капель раствора азотнокислого серебра. Образование тяжелого хлопьевидного осадка указывает на присутствие галоида. Хлористое серебро – белое (затем темнеющее на свету), бромистое – желтоватое, а йодистое – желтое. Если желательно уточнить, присутствует ли бром или йод, то к оставшейся части кислого раствора добавляют 1 см3 хлороформа или бензола и затем при встряхивании 2-3 капли 1%-ного раствора марганцевокислого калия. Дав смеси отстояться, отмечают окраску органического слоя; фиолетовая окраска указывает на присутствие йода, оранжевая или желтая – на присутствие брома. Однако избыток перманганата может обусловить фиолетовую окраску водного слоя, что не следует принимать за положительную реакцию на присутствие йода.
|
||||
|
Последнее изменение этой страницы: 2016-09-19; просмотров: 604; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.191.237.176 (0.011 с.) |