Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Качественный анализ. Общие сведения
Целью анализа является выявление отдельных элементов и ионов, входящих в состав вещества. Качественный анализ осуществляют химическими, физико-химическими физическими или биологическими методами. Химические методы основаны на химических реакциях между веществом аналитом и соответствующими реагентами. Следствием реакции должны быть изменения в системе, которые можно наблюдать визуально или с помощью приборов. Если изменения фиксируют визуально, то метод считают химическим. Если же изменения фиксируют прибором, то метод считают физико-химическим. Анализ можно осуществить и без химических реакций, лишь физическими операциями. Соответствующие методы считают физическими. Поскольку в физико-химических и физических методах используют специальные приборы, эти методы называют инструментальными. Наличие токсичных веществ в объектах окружающей среды можно определить биологическими методами. Мы будем изучать напивмикрометоды анализа с элементами микроанализа. Их преимуществами являются умеренные затраты объекта и реагентов, сокращение затрат времени из-за замены фильтрации на центрифугирования, резкое сокращение выбросов вредных газообразных веществ и связанное с этим улучшение санитарно-гигиенических условий работы. «Сухой» способ анализа. Здесь аналиты и реагенты имеем в твердом состоянии. Большинство таких определений связано с нагревом, образуя группу пирохимичних методов - окраска пламени, «перлов» (буры, соды и других веществ), нагрев в трубке для прожарки и др. В «сухих» относят и метод растирания порошков. Все «сухие» методы анализа используют только для вспомогательных и контрольных выражений. Метод окраски пламени основывается на способности некоторых элементов (щелочных, щелочно-земельных металлов, меди, бора и др.) Окрашивать пламя в определенный цвет. К примеру,
Готовят тщательно очищенную платиновую или нихромовую проволоку, один конец которой впаян в стеклянную
Метод окрашенного жемчуга. Некоторые вещества, стоплюючись с бурой (тетраборат натрия, Na2B4O7∙10 H2O) или с «фосфатной солью» (NaNH4HPO4∙4 H2O) и некоторыми другими соединениями, образуют окрашенное стекло - «перл». Получая «перлы» буры, ушко раскаленной платиновой проволочки вводят в твердую бурю, нагревают в пламени горелки, пока не прекратится вспучивание, охлаждают и, прикоснувшись к веществу, анализирующие полученным «перлом», снова вводят в пламя, затем охлаждают. Цвет «жемчуга» указывает на наличие того или иного элемента. Нагрев в трубке для прожарки позволяет анализировать вещества, способные к сублимации или разложения при нагревании. Если вещество сублимируется полностью, то можно Рядом с сублимацией нагрева может вызвать выделение различных газов и паров, которые дают информацию о качественном составе вещества. Например, кислород выделяется, если в пробе присутствуют перманганаты, нитраты, пероксиды и т.д.; диоксид углерода (СО2) - если разлагаются карбонаты; оксиды азота - если разлагаются нитраты или нитриты; испарения воды - если разлагаются кристаллогидраты, гидроксиды, органические соединения и др. Трубка для прожарки - это пробирка из тугоплавкого стекла или кварца, длиной 5-6 см, диаметром 0,5 см. Небольшое количество анализируемого вещества насыпают в эту пробирку, медленно и осторожно нагревают в пламени горелки и наблюдают за изменениями. Растирания порошков. Наличие компонентов обнаруживают по образованию соединений характерного цвета или запаха. Так, растирая смесь тиоцианата аммония (NH4SCN) и тиоцианата калия (KSCN) с солями железа(III) возникает красно-бурая окраска, а с солями кобальта(II) - синяя. Растирают в
«Мокрые» методы анализа. Большинство реакций KCl + AgNO3 Þ AgCl(s) + KNO3, BaCl2 + 2 CH3COOAg Þ 2 AgCl(s) + (CH3COO)2Ba.
Соединения хлора (например, KClO3), не дают иона хлорида, не образуют такой твердой фазы. Эти факты объясняет Cl‑ + Ag+ D AgCl(s), або Cl‑ + Ag+ D AgCl¯. Теоретически изучая анализ неорганических соединений, учитываем то, что большинство реакций обратимы (идут как в одну, так и в другую сторону). Призыв записывать реакции не в «молекулярной», а в «ионной форме» - слишком упрощен. Правильнее в них записывать те формы (ионы или молекулы), которые являются предпочтительными в системе. Представление о разнообразии реакций в системе и условия преобладание приведены в разделах «Закон действия масс. Алгебра химических реакций»и«Концентрационный-логарифмические диаґрамы». Химические элементы способны существовать в растворе как различные ионы, например Fe3+, Fe2+и комплексный ион Fe Fe(CN)64‑; Mn2+, MnO4‑и MnO42‑; Sn2+, Sn(OH)-3(гидроксокомплексов, то есть комплекс с лигандом ОН-, образованный Sn(II) заметим, что с точностью до H2O, на который часто не обращают внимания, записывая формулы реагентов в воде, совпадает с анионом кислоты станула(II), HSnO2‑, последняя форма характерна для российских учебников) и Sn(OH)42‑(гидроксокомплексов, образованный Sn(IV), или, по традициям российских учебников, SnO32 ‑, анион оловянной кислоты). Характерные реакции разработаны для многих различных окислительных состояний элементов, а также для различных инертных комплексов (то есть, что, в отличие от «лабильных комплексов», теряют лиганд с очень малой скоростью). Например, Fe3+ с ионом SCN- дает комплексы Fe(SCN) n 3‑ n , окрашенные в характерный красный цвет, тогда как Fe2+ подобного окраса не дает. Ион Fe2+ в растворе можно открыть действием реагента K3Fe(CN)6(красной кровяной соли), а ион Fe3+ - действием K4Fe(CN)6(желтой кровяной соли). В обоих случаях образуется синий осадок, который когда-то считали различные вещества, краску «берлинскаая лазурь» и «турнбулевой синь». Однако, способность реагентов к Fe(CN)63‑ + е‑ D Fe(CN)64‑, Fe2+ ‑ е‑ D Fe3+, ведет к тому, что в обоих случаях образуется осадок «берлинськой лазури», 4 Fe3+ + 3 Fe(CN)64‑ D Fe4{Fe(CN)6}3(s), причем интенсивную окраску как раз и связывают с наличием в составе элемента с различными окислительными состояниями. В литературе приводят значение произведения
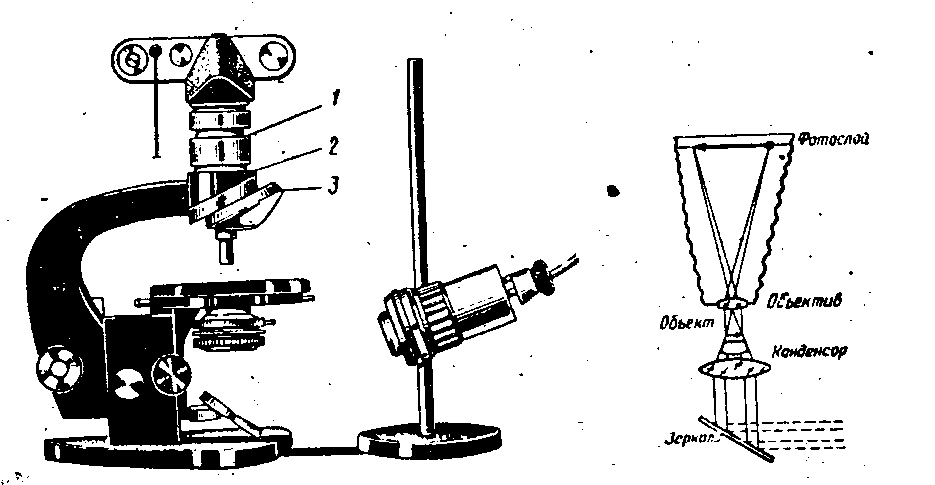
Выполнение качественных реакций в «мокрых» методах анализа. По способу выполнения различают пробирочные, микрокристалло-скопические и капельные реакции. Пробирочный метод заключается в том, что реагенты смешивают в специальных пробирках. В них наблюдают за образованием осадков, окрашенных соединений, газообразных продуктов. В центрифужных пробирках отделяют твердую фазу от раствора, используя центрифуґу (см дальше подразделение «Техника работы в лаборатории»). Микрокристаллоскопические реакции. Под микроскопом наблюдают за формой и окраской кристаллов, образованных с участием исследуемого компонента на поверхности тщательно вымытого и обезжиренного стекла. Каплю анализируемого раствора помещают на предметное стекло, рядом наносят каплю раствора реагента, соединяют капли стеклянной палочкой, не перемешивая растворы. Кристаллы, образовавшиеся в месте соприкосновения капель наблюдают через несколько минут. Зеркало микроскопа устанавливают так, чтобы хорошо осветить поле зрения. Поместив предметное стекло на предметный столик, устанавливают на расстоянии 10-12 мм объектив Предел обнаружения микрокристаллоскопических реакций, как правило, достаточно низкая. Чтобы еще ее снизить, каплю раствора подсушивают или испаряют и только после этого добавляют реагент. Преимущества метода - малый расход исследуемого веществ и реагента, скорость и простая техника.
Капельный анализ включает реакции как выявление, так и отделения. Их выполняют на фильтровальной бумаге. Одним из главных преимуществ этого метода является низкий предел обнаружения, что связано с капиллярными и адсорбционными явлениями в волокнах бумаги. Компоненты отличаются друг от друга скоростью диффузии в капиллярах и способностью к адсорбции. Поэтому компоненты с нанесенной капли накапливаются и отделяются в концентрических зонах, где их обнаруживают соответствующими реакциями. Распределение по зонам позволяет выявлять компонент без предварительного разделения многих других.
Итак, в капельном анализе неспецифическая реакция может стать специфической. Чтобы обеспечить более полный распределение по зонам, часто на фильтровальную бумагу предварительно наносят «подстилку» - каплю реагента, который в центре пятна дает с компонентами, мешающих малорастворимую соединение. По капельной методике возможно анализировать смеси раздробленным методом, сокращая затраты времени и реагентов. Рассмотрим в качестве примера капельную реакцию обнаружения Al3+ с ализарином, что образует с Al(ОН)3(s) растворим ярко-красный «алюминиевый лак». Окрашенные лаки способны образовывать и другие катионы. Поэтому применяют «подстилку» с K4[Fe(CN)6], гексацианоферрата(II) калия, образует малорастворимые соединения с нежелательными компонентами, оставляя их в центре пятна. Ионы Al3+ диффундируют на внешнюю часть, где их обнаруживают в аммиачной среде. Добавляя воду в центр пятна, вымывают и увеличивают скорость диффузии Al3+ с осадка сторонних компонентов.
|
||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-08-01; просмотров: 236; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.19.56.45 (0.012 с.) |