
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Оптические и спектральные методыСодержание книги Похожие статьи вашей тематики
Поиск на нашем сайте
Основные характеристики электромагнитного излучения Свет имеет двойственную природу – волновую и корпускулярную, поэтому для его описания используют два вида характеристик – волновые и квантовые. К волновым характеристикам относятся частота излучения (γ - Гц), длина волны (λ - м), волновое число (κ); к квантовым характеристикам относится энергия квантов (E). Волновое число κ показывает, сколько длин волн определенной частоты укладывается в 1 см. Эта величина обратна длине волны и измеряется в см-1. Так длина волн зеленого цвета укладывается в 1 см - 5 10-5 см-1. Частота излучения и длина волны связаны соотношением (формула 14):
где с – скорость света, 3 · 1010 см/с. Энергия электромагнитного излучения определяется следующим соотношением (формула 15):
где h – постоянная Планка, 6,26· 10-24 Дж·с. При взаимодействии вещества с излучением различной природы возможно возникновение следующих эффектов: поглощение или отражение части спектра, а так же изменение его характеристик. Диапазоны длин волн и виды явлений, происходящих при взаимодействии вещества и излучения, приведены в таблице 2. Спектральные и оптические методы классифицируют по следующим признакам: - по принадлежности электромагнитного излучения, воздействующего на исследуемый объект, к определенной части спектра (УФ - методы, ИК - методы); - по уровню взаимодействия электромагнитного излучения с веществом (атомная спектроскопия, молекулярная спектроскопия); - по протекающим физическим явлениям (эмиссионные методы, адсорбционные методы). Классификация спектральных и оптических методов по основным признакам приведена в таблице 1. 1). Абсорбционные методы – основаны на эффектах поглощения молекулами или свободными (невозбужденными) атомами определяемого элемента; ● Молекулярные абсорбционные (фотометрические) методы: - визуальная колориметрия – метод основан на сравнении интенсивности окрасок исследуемого окрашенного раствора и стандартного окрашенного раствора строго определенной концентрации, - фотометрия (фотоколориметрия) - метод основан на измерении поглощения света определенной длины волны не строго монохроматического излучения, - спектрофотометрия - метод основан на измерении поглощения света определенной длины волны монохроматического излучения, - турбидиметрия – метод основа на измерении количества света, поглощенного неокрашенной суспензией, - нефелометрия - метод основан на использовании явлений отражения или рассеивания света окрашенными или неокрашенными частицами взвешенного в растворе осадка; Таблица 2 – Виды атомных и молекулярных переходов
● Атомно-абсорбционные методы (например, атомно-абсорбционная спектроскопия). 2). Эмиссионные методы – основаны на эффектах излучения: ● эмиссионный спектральный анализ (эмиссионный пламенно-фотометрический анализ) - метод основан на изучении эмиссионных спектров (испускания, или излучения) элементов анализируемого вещества (измерение интенсивности спектральных линий в спектре испускания); ● люминесцентный анализ (флуоресцентный анализ, флуориметрия) - используется способность многих органических и неорганических веществ к самостоятельному свечению под различным воздействием (люминесценция) – измеряется интенсивность излучаемого ими видимого света. 3). Методы, связанные с поляризацией молекул вещества - основаны на эффекте изменения характеристикисходного излучения при прохождении через вещество: ● рефрактометрия - в основе метода лежит явление рефракции (преломления световых лучей на границе раздела двух фаз); ● интерферометрия – метод основан на измерении сдвига интерференции световых лучей, проходящих через кюветы с раствором вещества и растворителя. Вследствие разности хода лучей, на экране прибора образуются интерфериционные полосы, которые смещены относительно оптической оси прибора и связаны прямой пропорциональной зависимостью с концентрацией вещества в растворе; ● поляриметрия – основана на определении оптического вращения (вращения плоскости поляризации поляризованного - у которого колебания световых волн происходят только в одной плоскости - света раствором оптически активного вещества); отклонение плоскости поляризации от первоначального положения называют углом вращения плоскости поляризации. Величина угла вращения зависит от концентрации вещества в растворе.
Рефрактометрический метод Рефрактометрический метод анализа основан на измерении показателя преломления, который является индивидуальным свойством анализируемого вещества. При пересечении лучом света границ раздела двух прозрачных сред (1 и 2) направление луча изменяется, т.е. луч меняет траекторию или преломляется. Это явление называется рефракцией (рисунок 17). Таким образом, при преломлении луча, образуются два угла по отношению к перпендикуляру границы раздела сред: угол падения (α) и угол преломления (β).
Рисунок 17 – Преломление луча (рефракция) Отношение sin угла падения к sin угла преломления называется показателем преломления (формула 16):
n = sin α / sin β, (16)
где n - показателем преломления. Показатель преломления определяется поляризуемостью составляющих среду частиц, а также структурой среды и ее агрегатным состоянием. Чем больше показатель преломления, тем меньше угол отражения, а преломленный луч будет более близок к перпендикуляру. Так как показатель преломления стекла сильнее отличается от показателя преломления воздуха, чем показатель преломления воды, то луч, идущий из воздуха в стекло, преломляется сильнее, чем луч, идущий из воздуха в воду. В очень небольшой степени преломляется луч, переходящий из воды в стекло (рисунок 18). Показатель преломления изменяется в зависимости от длины волны проходящего света. Такая зависимость называется рефракционной дисперсией, вследствие которой при рефракции видимого света появляются радужные полосы. Показатель преломления является физической константой вещества, поэтому по его значению можно судить о чистоте вещества.
Рисунок 18 - Преломление светового луча
Показатель преломления зависит от температуры, т.е. при повышении температуры он уменьшается, а при снижении температуры – увеличивается. Величину изменения показателя преломления на один градус называют температурным коэффициентом. В справочной литературе обычно даны значения n20, т.е. значения коэффициента преломления при температуре 20 ºС. При преломлении света обычно не вся световая энергия луча переходит из одной среды в другую, так как часть её отражается. При увеличении угла падения соотношение между долей световой энергии, переходящей в другую среду, и долей световой энергии, отраженной от поверхности раздела, изменяется. Если угол падения непрерывно увеличивается (направления 1,2,3,4), то соответственно увеличивается и угол преломления (направления 1´,2´,3´,4´) (рисунок 19).
Рисунок 19 – Угол полного внутреннего отражения
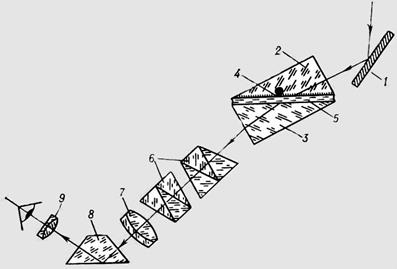
При максимальном значении угла падения α=90º, угол преломления также примет для данных двух сред (1, 2) максимальное значение, но β<90º. Величина предельного угла на границе двух сред зависит только от их показателя преломления. Если известен показатель преломления одного вещества, то показатель преломления другого вещества можно определить. Показатель преломления не зависит от величины угла, под которым направлен луч света и является одной из характерных констант вещества. Если луч света переходит из среды менее плотной в более плотную, то угол падения всегда больше угла преломления, то есть – α > β. В случае, если луч света переходит из среды более плотной в менее плотную, то угол падения меньше угла преломления, то есть – α < β. По отношению к воздуху все жидкие и твердые прозрачные среды более плотные и показатели преломления их больше единицы, поэтому угол падения α больше угла преломления β. На принципе измерения угла основано устройство большинства рефрактометров. Рефрактометры устроены так, что исследуемое вещество помещается между двумя призмами (двумя половинами призмы). Свет, пропущенный через призму, преломляясь или отражаясь от границы раздела сред (призма-вещество), освещает только часть шкалы, образуя достаточно резкую границу света и тени. Положение этой границы на шкале зависит от угла полного внутреннего отражения исследуемого вещества. На шкале указаны показатели преломления, соответствующие различным значениям угла полного внутреннего отражения. Оптическая схема рефрактометра представлена на рисунке 20.
Рисунок 20 - Оптическая схема рефрактометра
1 - осветительное зеркало; 2 - осветительная призма; 3 - измерительная призма; 4 - матированная грань освети- тельной призмы; 5 - исследуемая жидкость; 6 - призмы Амичи компенсатора; 7 - объектив зрительной трубы; 8 - поворотная призма; 9 - окуляр зрительной трубы Все измерения проводятся в видимом свете. Показатель преломления прозрачных сред определяется в проходящем свете, а полупрозрачных – в отраженном свете. При прохождении луча света через осветительную и измерительную призмы происходит дисперсия (разложение на спектры). Для того, чтобы монохроматический луч с длиной волны l = 589,3 мкм (длина волны желтой линии натрия) не отклонялся, перед объективом зрительной трубы помещают компенсатор. Лучи с другими длинами волн отклоняются призмами в различных направлениях. Перемещая призмы компенсатора с помощью нониуса, добиваются, чтобы граница света и тени стала возможно более чёткой. Лучи света, пройдя компенсатор, попадают в объектив зрительной трубы. Изображение границы раздела свет – тень рассматривается в окуляр зрительной трубы. Одновременно в окуляр рассматривается шкала. Оптическая система рефрактометра содержит также поворотную призму 5. Она позволяет расположить ось зрительной трубы перпендикулярно призмам 1 и 2, что делает наблюдение более удобным. Рефрактометрию широко применяют при установлении концентрации углеводов в различных продуктах, массовой доли сухих веществ. Этим методом пользуются также для количественного определения жиров в пищевых продуктах, для поэтапного контроля в процессе производства пищевых продуктов – кондитерских изделий, напитков, некоторых видов консервов.
Спектральные методы Спектральным анализом называют метод, основанный на изучении спектров и определении химического состава по спектру. Применительно к электромагнитному излучению под спектром понимают функцию распределения энергии излучения в зависимости от длины волны. Таким образом, спектр – упорядоченное по длинам волн излучение. Разложение в спектр осуществляется при помощи диспергирующего элемента (призма, дифракционная решетка). Пройдя через диспергирующий элемент излучение разделяется на наборы квантов соответствующих различным энергетическим переходам. которые образуют спектральные линии характерные для данного вещества. Для возбуждения спектров применяют чаще всего электрическую искру или дугу, а также газовое пламя; последние методы относятся к пламенной фотометрии. В дуговом, искровом, а иногда и в пламенном спектральном анализе применяют следующие типы приборов: - стилоскопы – визуальные приборы для качественного или полуколичественного анализа; - спектрографы – фиксируют спектр на фотопластинке; после чего пластинку проявляют и измеряют микрофотометром интенсивность почернения линий; - квантометры - приборы с фотоэлектрическим устройством. Спектральные методы дают широкие возможности для наблюдения и исследования соответствующих аналитических сигналов в различных областях электромагнитного спектра – рентгеновское излучение, ультрафиолетовое (УФ) излучение, видимый свет, инфракрасное (ИК), а также микро- и радиоволновое излучение. Классификация спектральных методов приведена в таблице 3. Таблица 3 – Классификация спектральных методов
Продолжение таблицы 3
По сравнению с другими аналитическими методиками спектральный анализ является наиболее простым, быстрым и чувствительным. В настоящее время определены спектры всех атомов и составлены таблицы спектров. С помощью спектрального анализа могут легко определяться многие элементы, присутствующие в веществе в количестве от 0,01 % до 0,001 % и меньше. К существенным недостаткам спектрального анализа относиться то, что интенсивность линии зависит от основного материала и от примесей, влияющих на возбуждение атомов в пламени. Спектры получают следующим образом: атомы анализируемого вещества излучают свет под действием высокой температуры, достигающей от плюс 2000 до плюс 3000 ºС в пламени, от плюс 3000 до плюс 7000 ºС в дуге и нескольких десятков тысяч градусов в искре. Излучение, полученное таким образом, разлагается в спектр призмой спектрального прибора и регистрируется фотографической пластинкой или фотоэлектрическим устройством. Оптический спектр охватывает ультрафиолетовую, видимую и инфракрасную область. Длины волн спектральных линий обычно выражаются в нанометрах или миллимикронах. Известны три типа эмиссионных спектров: линейчатые, полосатые и непрерывные или сплошные (рисунок 21). Линейчатые спектры испускаются атомами и ионами раскаленных газов и паров. Полосатые спектры возникают при излучении света раскаленными парами молекул. Непрерывные спектры испускаются раскаленными жидкими и твердыми телами. Спектроскопию условно можно разделить на эмиссионную и абсорбционную. Линейчатость спектров атомов связана с тем, что разность энергии переходов между энергетическими состояниями у атомов гораздо больше, чем ширина спектральных линий. В атомах возможны только электронные переходы, а в молекулах еще и колебательные и вращательные уровни, которые значительно ближе по энергии друг к другу (рисунок 21). В молекуле в пределах каждого электронного уровня располагается несколько колебательных уровней, а в пределах каждого колебательного уровня – несколько вращательных. Наложение вращательных и колебательных переходов размывает энергетические уровни электронных переходов. Молекулярным спектром. называют совокупность полос или линий в оптической (УФ, видимой, ИК) и микроволновой (МВ) областях электромагнитных волн, возникающих в результате изменения энергии молекул при поглощении, рассеянии или испускании электромагнитного излучения. Соответственно различают молекулярные спектры поглощения (абсорбционные), комбинационного рассеяния (КР) и испускания (эмиссионные). Молекулярные спектры, наблюдаемые в оптической области, называют оптическими, в МВ—микроволновыми. Вид и структура спектров определяются строением, энергетическими и электрическими свойствами молекул. Спектры молекул содержат более детальную информацию о веществе, чем атомные. По молекулярным спектрам можно судить не только об элементном составе вещества, но и о том, как атомы в молекуле соединены между собой. Кроме того, в процессе получения молекулярных спектров нет необходимости разрушать вещество.
а)
б)
в) Рисунок 21 – Типы спектров а) непрерывный или сплошной; б) полосатый; в) линейчатый Эмиссионная спектроскопия исследует излучательную способность вещества. К числу важнейших особенностей эмиссионного спектрального анализа относится высокая чувствительность определения некоторых элементов, скорость, объективность, универсальность. Фотоэлектрический спектрограф или квантометр позволяет в течение от 5 до 6 минут выполнить полный количественный анализ от 10 до 12 элементов. Абсорбционная спектроскопия исследует поглощательную способность вещества. Молекулярно-абсорбционная спектрометрия. В молекулярно-абсорбционной спектрометрии исследуют аналитические сигналы в области от 200 до 750 нм (ультрафиолетовое излучение и видимый свет), вызванные электронными переходами внешних валентных электронов, а также поглощение излучения в инфракрасной и микроволновой области, связанное с изменением вращения и колебания молекул. Ультрафиолетовые спектры поглощения обычно имеют две-три, иногда пять и более полос поглощения, и используются для качественного анализа в ультрафиолетовой части спектра. Для однозначной идентификации исследуемого вещества записывают его спектр поглощения в различных растворителях и сравнивают полученные данные с соответствующими спектрами сходных веществ известного состава. Если спектры поглощения исследуемого вещества в разных paстворителях совпадают со спектром известного вещества, то можно с большой долей вероятности сделать заключение об идентичности химического состава этих соединений. Для идентификации неизвестного вещества по его спектру поглощения необходимо располагать достаточным количеством спектров поглощения органических и неорганических веществ. Существуют атласы, в которых приведены спектры поглощения очень многих, в основном органических веществ. Особенно хорошо изучены ультрафиолетовые спектры ароматических углеводородов. Наиболее широкое распространение получил метод, основанный на изучении поглощения в видимой области спектра в интервале длин волн от 400 до 750 нм – фотометрия. Метод, основанный на поглощении излучения в различных частях инфракрасной области электромагнитного спектра, – инфракрасная спектрометрия. Чаще всего используют поглощение излучения в средней (длина волны от 2,5 до 25 мкм) и ближней (длина волны от 0,8 до 2,5 мкм) ИК-области. Инфракрасная спектрометрия.Инфракрасная спектрометрия (ИК) представляет собой один из новейших физических методов количественного и качественного анализа пищевых продуктов. Этот метод позволяет получать достаточно полную информацию о строении и составе органических веществ. ИК–излучение применяется для исследования жирнокислого состава молочных продуктов, широко используется для определения пестицидов в различных пищевых продуктах, при анализе пищевых красителей, а также для контроля технологических процессов при переработке растительного и животного сырья. Применение ИК-спектроскопии чаще оказывается более полезным в качестве дополнительного метода при проведении идентификации чистых веществ после хроматографического разделения сложных компонентов пищевых продуктов. ИК-спектр более точно характеризует вещество, чем температура плавления, показатель плавления или плотность. Метод ИК-спектроскопии используется для определения содержания в пищевых продуктах витаминов А, К, В1, В2, В6, С, никотиновой кислоты, токоферолов и каротина. В комбинации с хроматографией ИК-спектроскопию можно применять для исследования ароматических веществ и ряда органических соединений. Поглощение инфракрасного излучения связано с увеличением колебательной и вращательной энергий ковалентной связи, если оно приводит к изменению дипольного момента молекулы. Это значит, что почти все молекулы с ковалентными связями в той или иной мере способны к поглощению в инфракрасной области. Инфракрасные спектры многоатомных ковалентных соединений обычно очень сложны: они состоят из множества узких полос поглощения и сильно отличаются от обычных ультрафиолетовых и видимых спектров. Различия вытекают из природы взаимодействия поглощающих молекул и их окружения. Это взаимодействие (в конденсированных фазах) влияет на электронные переходы в хромофоре, поэтому линии поглощения уширяются и стремятся слиться в широкие полосы поглощения. В инфракрасном спектре, наоборот, частота и коэффициент поглощения, соответствующие отдельной связи, обычно мало меняются с изменением окружения (в том числе с изменением остальных частей молекулы). Линии тоже расширяются, но не настолько, чтобы слиться в полосу. Образование инфракрасных спектров связано с энергией колебаний молекул. Колебания могут быть направлены вдоль валентной связи между атомами молекулы, в таком случае они называются валентными. Различают симметричные валентные колебания, в которых атомы колеблются в одинаковых направлениях, и асиммeтpичныe валентные колебания, в которых атомы колеблются в противоположных направлениях. Если колебания атомов происходят с изменением угла между связями, они называются деформационными. Такое разделение весьма условно, потому что при валентных колебаниях происходит в той или иной степени деформация углов и наоборот. Энергия деформационных колебаний обычно меньше, чем энергия валентных колебаний, и полосы поглощения, обусловленные деформационными колебаниями, располагаются в области более длинных волн. Колебания всех атомов молекулы обусловливают полосы поглощения, индивидуальные для молекул данного вещества. Но среди этих колебаний можно выделить колебания групп атомов, которые слабо связаны с колебаниями атомов остальной части молекулы. Полосы поглощения, обусловленные такими колебаниями, называют характеристическими полосами. Они наблюдаются, как правило, в спектрах всех молекул, в которых имеются данные группы атомов. Атомная спектроскопия (фотометрия пламени) В атомной спектроскопии вещества исследуют, переводя их в состояние атомного пара – атомно-абсорбционная спектроскопия или газообразное состояние – атомно-эмиссионная спектроскопия. В атомно-абсорбционной спектроскопии для возбуждения атомов используют тепловую энергию. Распыляя образец в пламени, соединения переводят в атомный пар (атомизация). Большинство атомов, возбуждаясь, переходит на более высокий энергетический уровень. При обратном переходе происходит выделение энергии. В процессе облучения атомов исследуемого элемента, находящихся в состоянии пара, линейчатым излучением того же самого элемента в возбужденном состоянии происходит резонансное поглощение. Этот процесс сопровождается уменьшением интенсивности линейчатого излучения. Измеряемое поглощение является мерой концентрации свободных атомов образца. В атомно-эмиссионной спектроскопии возбуждения происходят при помощи электрических зарядов. При этом создаются высокие температуры, благодаря которым большинство атомов переходит в возбужденное состояние. Поглощение энергии этими атомами невозможно, поэтому происходит эмиссия (испускание) фотонов возбужденных атомов. Метод атомной спектроскопии находит широкое применение в химии, биохимии, экологии и др., а также в анализе различных видов сырья и пищевых продуктов. На рисунке 22 представлены спектрограммы растворимого кофе марки «Maxwell Hause» двух наименований - Original и Original Dekaf. Метод позволяет определить около 70 различных элементов; используется для одновременного определения большого числа элементов (многоэлементный анализ); для серийного анализа, благодаря высокой чувствительности и быстроте. К числу недостатков спектрального анализа следует отнести влияние структуры и химической неоднородности анализируемых материалов на результаты определения; отсутствие стабильных источников возбуждения спектров, а также трудность эталонирования.
а) б) Рисунок 22 – Спектрограммы кофе «Maxwell Hause» а) Original б) Original Dekaf
Спектроскопия магнитного резонанса. Масс-спектроскопия Метод основан на определении масс отдельных ионизированных атомов, молекул и радикалов посредством разделения потоков ионов, содержащих частицы с разным отношением массы к заряду, в результате комбинированного действия электрического и магнитного полей. При использовании данных методов возможно протекание следующих процессов: - ионизация атомов и молекул и последующее разделение образующихся ионов в магнитном и электрическом полях, - разделение газообразных ионов в магнитном поле в зависимости от отношения массы иона к его заряду. Выделяют следующие виды методов спектроскопии: - Масс-спектрометрия – разделение достигается электрическим способом; - Масс-спектрография – разделение достигается фотографическим способом. Применение радио- и микроволновой областей электромагнитного спектра в аналитической химии и физико-химических исследованиях основывается на явлениях ядерного магнитного и электронного парамагнитного резонансов. Спектрометрия ядерного магнитного резонанса изучает магнитный резонанс, возникающий в результате взаимодействия магнитного момента ядра с внешним магнитным полем. Вещество, исследуемое методом ядерного магнитного резонанса (ЯМР), помещают одновременно в два магнитных поля – одно постоянное, а другое радиочастотное. Измерение осуществляют на ЯМР-спектрометре, основными составляющими элементами которого являются: электромагнит (в простых приборах используют постоянный магнит); генератор радиочастотного излучения; датчик, в который помещают пробирку с образцом; электронный усилитель и интегратор; самописец. Методы ЯМР значительно производительнее, по сравнению с базовыми методами анализа, и во многих случаях отличаются меньшей погрешностью определения, вместе с тем они требуют использования специально подготовленных образцов сравнения и иногда взвешивания пробы. Данные методы используют в основном для оценки состояния и свойств воды и жира в сырье и готовой продукции. Масс-спектрометрия занимает особое положение среди спектроскопических методов. Этот метод получил свое название из-за формального сходства и графического изображения масс-спектров со спектрами спектроскопических методов. В масс-спектроскопии вещество не подвергается воздействию электромагнитного излучения. Метод основан на изучении тока от фрагментов ионов, полученных из нейтральных молекул вещества путем воздействия на них пучка электронов. Метод масс-спектрометрии применяют в научно-исследовательской практике для идентификации соединений и установления строения неизвестных веществ, точного определения молекулярной массы, определения элементного состава, анализа следовых количеств биологически активных соединений, определения аминокислотной последовательности пептидов, анализа многокомпонентных смесей и т.д.
Фотоколориметрический метод В фотометрическом анализе определяемое вещество переводят в окрашенное соединение, после чего измеряют светопоглощение раствора. Фотометрические методы количественного анализа основаны на избирательной способности различных веществ и их растворов поглощать световой поток. В зависимости от способа измерения светопоглощения различают несколько методов фотометрического анализа: - визуальное сравнение интенсивности окраски по отношению к известному стандарту называют визуальной колориметрией. - если для измерения светопоглощения применяют светоэлемент со светофильтром, то прибор называют фотометром или фотоэлектроколориметром (рисунок 23), а метод анализа – фотоколориметрическим. Этот метод основан на анализе немонохроматического света. - метод, основанный на поглощении монохроматического света, называется спектрофотометрическим, а прибор – спектрофотометр. Основные области применения фотометрического анализа те же, что и спектрального анализа. Его используют для определения редуцирующих веществ, общего сахара, алкоголя, цветность патоки, качества красителей, содержание некоторых тяжелых металлов. Результаты при фотометрическом анализе более точные, нет необходимости применять заранее проверенные стандарты. Фотометрические методы широко применяются для автоматического, а также для дистанционного анализа. Фотоэлектрические методы измерения интенсивности окраски связаны с использованием приборов – фотоколориметров.
Рисунок 23 – Внешний вид фотоэлектроколориметра КФК-3 В отличие от приборов, в которых сравнение окрасок производится визуально, в фотоэлектроколориметрах приемником световой энергии является прибор – фотоэлемент. В этом приборе световая энергия преобразует в электрическую. Фотоэлементы позволяют проводить колориметрические определения не только в видимой, но также в УФ- и ИК-областях спектра. Измерение световых потоков с помощью фотоэлектрических фотометров более точно и не зависит от особенностей глаза наблюдателя. Применение фотоэлементов позволяет автоматизировать определение концентрации веществ в химическом контроле технологических процессов. Вследствие этого фотоэлектрическая колориметрия значительно шире используется в практике заводских лабораторий, чем визуальная. Основными узлами фотоколориметра являются: источник излучения, устройство для выделения излучения в узком диапазоне длин волн (в идеале монохроматического излучения), блок преобразователя сигнала, приемник излучения. Диспергирующий элемент разлагает излучение в спектр. Это наиболее важная часть спектрального прибора, в значительной степени определяющая его аналитические возможности и основные характеристики: линейную дисперсию и разрешающую способность. В качестве диспергируещего элемента используют призмы, дифракционные решетки и интерференционные устройства. Призмы изготовляют из стекла и кварца. Стеклянные призмы применяют при работе в видимом и ближнем инфракрасных участках спектра. Призмы из кварца используют при работе в ультрафиолетовом участке спектра. В современных приборах используют главным образом дифракционные решетки, которые представляют собой хорошо отражающую поверхность с большим числом начерченных или вытравленных равноотстоящих штрихов (от 300 до 2000 линий на 1 мм). Вращая дифракционную решетку по отношению к падающему лучу, можно последовательно, направлять на приемник излучения (детектор) различные спектральные линии. Разрешающей способностью спектрального прибора называют его способность давать раздельное изображение двух спектральных линий с близкими длинами волн. Дифракционные решетки имеют более высокую разрешающую способность, чем призмы. Таблица 4 - Выбор длинны волны светофильтра по окраске исследуемого раствора
Монохроматор. Из совокупности линий, испускаемых источником, лишь некоторые эффективно поглощаются атомами. Для отделения спектральной линии, интенсивность которой необходимо измерить, используется монохроматор. Его основные детали — щели, линзы, зеркала и диспергирующие элементы (призмы, дифракционные решетки). Светофильтры. Для выделения из спектра участка большой протяженности (грубая монохроматизация) используют простейшие устройства, называемые светофильтрами. Различают газовые, жидкие и твердые светофильтры. Они выделяют из исследуемого излучения участок шириной ∆l, называемой полосой пропускания светофильтра. Качество светофильтров оценивают отношением средней длины волны lср к ширине полосы ∆l. Значение ∆l определяется по точкам, где пропускание фильтра составляет половину максимальной. Выбор светофильтра определяется цветом исследуемого раствора (таблица 4) Оптическая схема фотоколориметра КФК-3, используемого для проведения состава продовольственных товаров, представлена на рисунке 24.
Рисунок 24 - Оптическая схема фотоколориметра КФК-3 Сущность фотоколориметрического метода заключается в измерении степени поглощения света окрашенными растворами в видимой части спектра (с длиной волны от 400 до 760 нм). Если световой поток направить на кювету с дистиллированной водой, то интенсивность его практически не изменится. Если же поток света падает на кювету с окрашенным раствором, то часть его отражается от поверхности кюветы, часть будет поглощаться раствором и часть пройдет через него. При этом произойдет изменение интенсивности светового потока, прошедшего через окрашенный раствор – It, по сравнению с исходным – I0 (рисунок 25). Интенсивность светового потока уменьшается.
Рисунок 25 - Изменение интенсивности светового потока при прохождении через разные среды Отношение Степень поглощения окрашенными растворами волн падающего света различной длины неодинакова и зависит от природы частиц окрашенного вещества. Эта зависимость выражается основным
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-18; просмотров: 2196; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.148.105.127 (0.017 с.) |

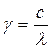 , (14)
, (14) , или
, или  (15)
(15)









 характеризует пропускание (поглощение) света. Таким образом, светопропускание показывает, во сколько раз изменяется интенсивность светового потока при прохождении через окрашенный раствор, и его значения изменяются от 0 до 1. Кроме того светопропускание может быть выражено в %. Если, величину светопропускания отнести к толщине слоя в 1 см, то ее называют коэффициентом пропускания.
характеризует пропускание (поглощение) света. Таким образом, светопропускание показывает, во сколько раз изменяется интенсивность светового потока при прохождении через окрашенный раствор, и его значения изменяются от 0 до 1. Кроме того светопропускание может быть выражено в %. Если, величину светопропускания отнести к толщине слоя в 1 см, то ее называют коэффициентом пропускания.


