
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Никеля в молоке методом тонкослойной хроматографииСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Выполнение работы Приборы: 1. Хроматографические стеклянные камеры диаметром d=32 см, высотой h = 10 см 2 шт., с пришлифованными стеклянными крышками. 2. Хроматографические пластины «Силуфол». 3. Стеклянные трубочки-капилляры для нанесения анализируемых растворов в точки на линии «старта». 4. Пульверизаторы для опрыскивания слоя адсорбента реактивом-проявителем после разделения анализируемой смеси - 2 шт. Посуда: 1. Мерные цилиндры вместимостью 50 см3 - 3 шт. 2. Стеклянные воронки – 2 шт. 3. Фарфоровая чашка для выпаривания – 1 шт.
Реактивы: 1. 10%-ные водные растворы FeCl3, CuCl2, Co(NO3)2, и Ni(NO3)2 в качестве свидетелей. 2. Растворитель - элюент № 1 состава: Этанол - разбавленная вдвое конц. HCl в отношении 4:1, общим объемом 50 см3. 3. Растворитель - элюент № 2 состава: ацетон – 3 н HCl в отношении 9:1, общим объемом 50 см3. 4. Реактив - проявитель № 1 – 10%-ный р-р гексациано-II-феррата калия K4[Fe(CN)6]. 5. Реактив - проявитель № 2 – 25%-ный р-р NH4OH.
Техника определения 1. Взятие пробы анализируемого вещества. С помощью мерного цилиндра отбирают 50 см3 молока, переносят в фарфоровую чашку для выпаривания и упаривают молоко на водяной бане до объема 5-10 см3. Нанесение на адсорбент р-ра пробы и свидетелей. 2. Берут две хроматографические пластины «Силуфол». На слое сорбента проводят графитовым карандашом стартовую линию в 15-20 мм вдоль узкой стороны пластинки. На стартовой линии отмечают 3 точки с равными интервалами. А) Подготовка хроматографической пластины № 1. Осторожным прикосновением стеклянного капилляра в первую точку на стартовой линии наносят свидетель - 10% раствор FeCl3, во вторую точку другим капилляром - другой свидетель - 10%-ный раствор CuСl2, в третью точку третьим капилляром наносят подготовленную пробу молока. Б) Подготовка хроматографической пластины № 2. Аналогично пункту а) в три точки на стартовой линии пластины с помощью трех разных капилляров наносят р-ры свидетелей - 10% р-р Ni(NO3)2 и пробу молока. Хроматографические пластины выдерживают 5-10 минут для испарения растворителя или осторожно подсушивают над плиткой (или в сушильном шкафу). 3. Подготовка хроматографических камер и пропускание растворителя. А) В мерный цилиндр с притертой пробкой наливают 40 см3 этанола и 10см3 HCl (1:1), закрывают пробкой и встряхивают. После перемешивания готовой растворитель помещают на дно чистой и сухой хроматографической камеры № 1, таким образом, чтобы уровень растворителя не касался стартовой линии. Б) В другой мерный цилиндр с притертой пробкой наливают 45 см3 3 н HCl, закрывают пробкой и встряхивают. После перемешивания готовый растворитель помещают на дно чистой и сухой хроматографической камеры № 2, таким образом, чтобы уровень растворителя не касался стартовой линии. Хроматографические камеры тщательно закрывают крышками во избежание улетучивания растворителя и наблюдают движение по слою фронта растворителя за счет сил адсорбции. Когда фронт растворителя приблизится к верхнему краю до 1 см, пластинки вынимают, сразу же отмечая положение фронта графитовым карандашом и подсушивают 5-10 мин. 4. Проявление хроматограмм. Пластинку с высушенным слоем опрыскивают из пульверизатора реактивом - проявителем. Либо на воздухе, либо в специальной камере в течение 10-15сек. Хроматографическую пластинку № 1 опрыскивают реактивом-проявителем № 2. Вещество-свидетель и компоненты разделенной смеси, увлеченные растворителем на характерное для них расстояние (коэффициент пробега Rf) обнаруживают по окрашиванию за счет образования нерастворимых цветных осадков: синего цвета Fe4[Fe(CN)6]3 и красно-бурого цвета и растворимых аминокомплексов кобальта [Co(NH3)6]2+ розового цвета, [Ni(NH3)6]2+ голубого цвета (написать уравнение и дать полное химическое название). Полученные хроматограммы перерисовывают на кальку, рассчитывают Rf и делают заключение о присутствии ионов Fe3+, Cu2+, Co2+, и Ni2+ в исследуемом образце молока.
РАБОТА № 3 ОБНАРУЖЕНИЕ АНИОНОВ ДРОБНЫМ МЕТОДОМ Обнаружение анионов чаще всего ведут дробным методом, т.е. в отдельных порциях исследуемого раствора. Групповые реагенты используют для установления наличия или отсутствия целой группы анионов, а также для их разделения. Обнаружение иона SO 42- Сульфат-ион SO42- является анионом серной кислоты. Из солей H2SO4 малорастворимы в воде соли бария, стронция, свинца и кальция. Для обнаружения аниона SO42- пользуются хлоридом бария BaCl2: SO42- + Ba2+ → BaSO4(т) Образующийся осадок сульфата бария не растворяется в кислотах. Выполнение реакции. К 1-2 каплям исследуемого раствора прибавляют 2-3 капли раствора BaCl2. Выпадающий белый осадок отделяют от раствора. Изучают действие кислот на осадок. BaSO4 – малорастворимая соль сильной кислоты, в кислотах нерастворим. Этим BaSO4 отличается от солей бария других анионов, чем и пользуются при обнаружении.
Обнаружение иона Cl- Хлорид-ион Cl- является анионом соляной кислоты HCl. Из солей соляной кислоты нерастворимы в воде соли серебра, ртути (I), свинца, а также основные соли висмута, сурьмы и олова. Остальные хлориды хорошо растворимы. Реакция с нитратом серебра. AgNO3 образует с Cl- белый творожистый осадок AgNO3; на свету осадок становится серо-фиолетовым, а затем чернеет: Ag+ + Cl- → AgCl(т) Осадок AgCl нерастворим в кислотах HNO3, H2SO4. Однако AgCl легко растворяется при действии веществ, способных связывать ион Ag+ в комплекс, например, NН3, Na2S2O3 и др. AgCl(т) + 2NH3 →[Ag(NH3)2]+ + Cl- AgCl, в отличие от осадков AgBr, AgJ и AgSCN, растворим в (NH4)2CO3.
Выполнение реакции. К 2 мл исследуемого раствора приливают 1 мл раствора. AgNO3 к осадку приливают раствор аммиака, (до рН≥8) энергично взбалтывают содержимое. Раствор сливают в чистую пробирку и приливают HNO3 до кислой реакции (по универсальному индикатору). В присутствии Ag+ снова образуется белый творожистый осадок.
Обнаружение иона NO3- Нитрат-ион NO3- является анионом азотной кислоты, одной из самых сильных минеральных кислот. Все нитраты, за исключением основных солей висмута и ртути, растворимы в воде. Для обнаружения NO3- применяется в основном реакции его восстановления. Реакция с дифениламином. HNO3 окисляет дифениламин, что сопровождается появлением интенсивно-синей окраски. Эту же реакцию дают и другие окислители, имеющие достаточно высокий стандартный потенциал, такие, как NO2-, CrO42-, MnO4-, Fe3+. Выполнение реакции. На тщательно вымытое и досуха вытертое часовое стекло или в фарфоровую чашку помещает 2-3 капли раствора дифениламина в концентрированном растворе H2SO4 (если наблюдается посинение раствора, стекло или чашка были недостаточно чистыми). Вносят туда же на кончике чистой стеклянной палочки немного испытуемого раствора и перемешивают. В присутствии нитрат-иона NO3- появляется интенсивно-синяя окраска. Вопросы для самопроверки 1. В чем различие дробного и систематического качественного химического анализа? 2. Какие реагенты называются групповыми? 3. Написать реакции обнаружения ионов Cu2+, Fe3+, Pb2+, Cr3+, Mn2+. 4. В чем заключается классификация анионов? Привести примеры реакций. 5. Написать реакции обнаружения анионов Cl-, SO42-, NO3-. 6. Какие ионы можно обнаружить с помощью пламени? 7. Привести примеры использования комплексообразования для открытия ионов. Написать реакции. 8. Для обнаружения каких ионов используются окислительно-восстановительные реакции. Написать уравнения реакций. 9. В чем заключаются преимущества качественного анализа методом ТСХ? 10. В чем заключается процесс хроматографирования. 11. Как производится идентификация веществ в методе ТСХ. 12. Что такое Rƒ, способ расчета. 13. Какие сорбенты использюутся в методе ТСХ. 14. В чем заключается сущность метода качественного хроматографического обнаружения катионов металлов (Co2+, Ni2+, Cu2+, Fe3+ и др.)?
Часть II. К О Л И Ч Е С Т В Е Н Н Ы Й А Н А Л И З В данном практикуме изложены основные титриметрические методы химического анализа.
ТИТРИМЕТРИЧЕСКИЙ АНАЛИЗ Титриметрический анализ основан на том, что вещества реагируют между собой в определенных количественных отношениях. Грам – эквивалентом вещества называется количество граммов его, взаимодействующее с одним молем однозарядных ионов или электронов данной реакции, т.е. эквивалентное одному электрическому заряду в уравнении реакции. За единицу объема в титриметрии принимают 1 л (объем, занимаемый водой массой 1 кг при 3,93° С). Концентрация раствора, выраженная числом грамм – эквивалентов вещества в 1 л раствора, называется нормальностью (N). Сущность титриметрического анализа заключается в установлении точки эквивалентности (ТЭ) при взаимодействии растворов веществ, концентрация одного из которых известна. Точка эквивалентности может быть зафиксирована визуально или инструментально, с введением индикатора или без него. В точке эквивалентности количество эквивалентов реагирующих веществ равно, т.е. n1 = n2. Основываясь на равенстве количеств эквивалентов реагирующих веществ в точке эквивалентности, получают основное соотношение, используемое для расчетов в титриметрическом анализе: n1 = n2; N1 · V1 = N2 · V2, где n1 и n2 – количество эквивалентов реагирующих веществ; N1 и N2 – нормальности реагирующих веществ; V1 и V2 – их объемы. Так как в титриметрическом анализе обычно пользуются растворами, взятыми в миллилитрах, то удобнее все расчеты первоначально производить в миллиграмм – эквивалентах: в 1 мл столько миллиграмм – эквивалентов, сколько в 1 л грамм – эквивалентов (мл – тысячная часть литра, мг – тысячная часть грамма). Поэтому произведение N . V, где V выражено в мл, равно числу миллиграмм – эквивалентов: N1 · V1 (мг - экв) = N2 · V2(мг - экв). Концентрацию исследуемого раствора рассчитывают исходя из объема и концентрации титранта в точке эквивалентности: Nx = Методы титриметрии классифицируют в зависимости от типа используемой реакции, лежащей в основе титрования, а также по рабочему раствору метода (титранту): 1.) Кислотно-основное титрование; 2.) редоксиметрия или окислительно-восстановительное титрование (перманганатометрия, иодометрия и др.); 3) осадительное титрование (аргентометрия, роданидометрия и др.). 4) комплексонометрическое титрование. Во всех методах титриметрического анализа в качестве стандартных растворов с известной концентрацией используются 2 типа растворов: а) растворы первичных стандартов; они приготовляются путем растворения известной навески исходного вещества в определенном объеме воды (в мерной посуде); нормальность таких растворов рассчитывается по формуле: N = б) растворы вторичных стандартов; они приготовляются примерно нужной нормальности в больших склянках; точная нормальность таких растворов устанавливается путем их стандартизации (методом титрования) по первичным стандартам. Поскольку при титровании расходуется количество реагента, эквивалентное количеству титруемого вещества, нужно уметь зафиксировать окончание реакции, т.е. точку эквивалентности (ТЭ). Способы установления ТЭ разнообразны: визуальные (с помощью индикаторов и безиндикаторные), физико-химические. Для выбора метода установления ТЭ целесообразно рассчитать кривую титрования. Кривая титрования – это графическое изображение какого – либо параметра системы (например, величина рН, потенциала, электропроводности и т.п.), зависящего от изменяющегося состава раствора в процессе титрования. На любой кривой титрования имеются области плавного (до и после ТЭ) и резкого (вблизи ТЭ) изменения рассчитываемого параметра. Резкое его изменение называется скачком титрования. Для установления ТЭ необходимо выбрать индикатор, окраска которого изменяется в пределах скачка титрования. Значение рН, при котором изменяется окраска индикатора, называется конечной точкой титрования (КТТ), а область рН, в которой человеческий глаз улавливает изменение окраски – интервалом перехода окраски индикатора. Несовпадение КТТ и ТЭ вызывает индикаторную ошибку титрования. Это систематическая ошибка, которую можно рассчитать. В титриметрических методах анализа объемы растворов измеряются с помощью пипеток, бюреток и мерных колб. Вся мерная посуда перед работой должна быть проверена и тщательно вымыта. При заполнении раствором пипетки или бюретки ее необходимо предварительно ополоснуть этим же раствором. Процесс титрования следует повторить не менее 3-х раз при расхождении в результатах, не превышающем ± 0,1 мл. К и с л о т н о-о с н о в н о е т и т р о в а н и е Основная реакция: H3O+ + OH- = 2H2O или H+ + OH- =H2O
РАБОТА № 4
|
||||||||||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 583; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.216.208.243 (0.009 с.) |



 2) Na2CO3 – карбонат натрия, х.ч., 0,1 н. раствор
ЭМ =
2) Na2CO3 – карбонат натрия, х.ч., 0,1 н. раствор
ЭМ =  Б. Для стандартизации щелочей
1) H2C2O4 · 2H2O – щавелевая кислота; 0,1 н. раствор
ЭМ =
Б. Для стандартизации щелочей
1) H2C2O4 · 2H2O – щавелевая кислота; 0,1 н. раствор
ЭМ = 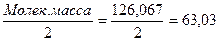 2) H2C4H4O4 - янтарная кислота; 0,1 н. раствор
ЭМ =
2) H2C4H4O4 - янтарная кислота; 0,1 н. раствор
ЭМ = 



