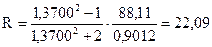Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Тема 4. 2. Хроматографический метод анализаСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Теоретические основы хроматографии. Классификация хроматографических методов анализа. Схема хроматографа.
Студент должен: знать: - сущность хроматографических методов; - виды хроматографии; уметь: - подготовить к работе ионообменную колонну;
Хроматографический метод анализа основан на избирательной адсорбции различных веществ твердыми адсорбентами. Сущность метода заключается в том, что через стеклянную или металлическую трубку, заполненную адсорбентом, пропускают смесь нескольких компонентов. Компоненты адсорбируют по-разному, они переместятся в колонке на разные расстояния и каждый компонент образует зону, окрашенную в определенный цвет, такое распределение компонентов по зонам называется хроматограммой. Если компоненты не окрашены, хромотограммы проявляют, приливая в колонку реактив, дающий с поглощенными компонентами окрашенное соединение.
Виды хроматографии
1. Адсорбционная – основана на избирательной адсорбции компонентов смеси. 2. Осадочная – основана на различной растворимости осадков, выпадающих в колонке в определенном порядке. 3. Ионообменная хроматография. В случае электролитов происходит так называемая обменная адсорбция: ион из раствора поглощается адсорбентом, а взамен его в раствор переходит ион адсорбента; этот ион входит в состав адсорбента или содержится в нем в качестве примеси. Обменная адсорбция – перераспределение ионов между двумя жидкими фазами, одна из которых неподвижна, а другая – подвижна. 4. Распределительная (тонкослойная).
Лабораторная работа
1. Определение нитрата магния в растворе
Тема 4.3. Рефрактометрический метод анализа
Сущность рефрактометрического анализа. Область применения. Зависимость показателя преломления от различных факторов. Схема рефрактометра.
Студент должен: знать: - теоретические основы рефрактометрического анализа; - правила работы с рефрактометром.
В основе рефрактометрического метода анализа лежит определение показателя преломления исследуемого вещества, так как индивидуальное вещество характеризуется определенным показателем преломления. Рефрактометрический метод анализа можно применять для двойных систем, например для определения концентрации вещества в водном или органическом растворах. В этом случае анализ основан по зависимости показателя преломления раствора от концентрации растворимого вещества.
Показатель преломления
Если луч света проходит из одной среды в другую, то направление его меняется. Он преломляется. Показатель преломления, равный отношению синуса угла падения к синусу угла преломления – это величина постоянная и характеризуется для данной среды.
где a и b - углы между направлением лучей и перпендикуляром к поверхности раздела обеих сред. Показатель преломления – отношение скоростей света в воздухе в исследуемой среде (если луч света падает из воздуха). Показатель преломления зависит от ряда внешних факторов: длины волны падающего света, температуры, а для газов и от давления. С увеличением длины волны показатель преломления уменьшается. С повышением температуры показатель преломления уменьшается. Поэтому измерение надо проводить при постоянной температуре. Обозначается показатель преломления, указывают длину волны падающего света и температуру измерения. Например, запись Чтобы исключить влияние внешних факторов (длину волны падающего света, температуру и давление) на показатель преломления, вводят понятие мольной и удельной рефракций.
где R – мольная рефракция, см3/моль; n – показатель преломления M – грамм – молекулярная масса. d – плотность вещества, г/см3. На практике для определения мольной рефракции измеряют показатель преломления вещества и его плотность. По формуле (1) вычисляют значение мольной рефракции. По табличным данным проводят проверку экспериментальных результатов, для чего суммируют атомные рефракции. Совпадение найденных значений с экспериментальными подтверждает правильность анализа исследуемого вещества. Расхождения допускаются в пределах 0,2-0,4 см3/моль для более простых соединений, а для очень сложных – в пределах 0,1-0,2 см3/моль.
Таблица 6 – Грамм-атомных рефракций элементов, двойных и тройных связей
Пример
Вычислить мольную рефракцию этилацетата СН3СООС2Н5, молекула которого состоит из 4 атомов углерода, 8 атомов водорода, 1 атома карбонильного кислорода и 1 атома гидроксильного кислорода. Согласно таблице имеем:
Опытным путем определено, что показатель преломления этилацетата, грамм молекулярная масса которого 88,11 г и плотность 0,9012 г/см3 равен 1,3700. Согласно формуле (1) имеем:
Следовательно, мольная рефракция, полученная расчетным путем и определенная опытным путем, почти совпадают. Мольную рефракцию смеси также можно рассчитать. Например, для смеси А, В и С.
Измерение показателя преломления методом предельного угла (1). Принцип работы рефрактометра (1).
Лабораторные работы
|
||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 558; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.214 (0.007 с.) |

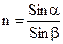
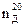 означает, что показатель преломления измерен при 20°С, длина волны падающего света 589 мкм. В технических справочниках показатели преломления приведены для
означает, что показатель преломления измерен при 20°С, длина волны падающего света 589 мкм. В технических справочниках показатели преломления приведены для 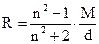 ;
; 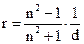 (1)
(1)