
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Основные составляющие титриметрической системыСодержание книги
Поиск на нашем сайте
Каждая титриметрическая система включает 3 обязательные составляющие: анализируемый объект, титрант и индикатор. Определяемое вещество – это химический элемент, простое или сложное вещество, атомы, ионы или радикалы, содержание которых определяют в образце анализируемого продукта (анализируемый объект). Реагент, добавляемый к анализируемому веществу (раствору), называют титрантом. Он может быть газообразным, твердм или жидким. Во всех случаях он содержит активное вещество Т в точно известной концентрации, которое принимает участие в реакции титрования. В титриметрическом анализе в качестве титрантов используют растворы точно известной концентрации, называемые стандартными или рабочими. Чтобы подчеркнуть факт и метод установления концентрации, их называют стандартизированными, титрованными, а сам процесс установления (нахождения) концентрации активного агента в растворе – стандартизацией. Титранты независимо от их агрегатного состояния должны удовлетворять ряду требований. Они должны: а) легко и быстро приготавливаться; б) анализироваться простыми и общедоступными методами; в) растворяться (смешиваться) в необходимых соотношениях с требуемым раствором; г) быть устойчивым в течение достаточно длительного времени; д) химически чистыми; е) имеющими постоянную формулу. готовят стандартный раствор в мерной колбе, навеску взвешивают на аналитических весах. Приготовить стандартный раствор можно также из фиксанала (это точно отвешенные количества твердых химически чистых веществ или точно отмеренные в запаянные стеклянные ампулы. Фисканалы приготавливают на химических заводах или в специальных лабораториях). Индикаторы – это вещества, изменяющие свою окраску, в зависимости от рН раствора. Согласно индикаторной теории Освальда, - это слабые кислоты или основания, цвет молекул которых отличается от цвета ионов. лакмус Индикаторы характеризуются интервалом перехода и показателем титрования. Интервал перехода – это интервал значения рН, при котором происходит заметное изменение окраски индикатора. Показатель титрования (рТ) – это то значение рН, в интервале перехода при котором окраска индикатора меняется наиболее резко. При выборе индикатора необходимо, чтобы его показатель титрования находился как можно ближе к точке эквивалентности.
Таблица 5 – Характеристика некоторых часто используемых индикаторов
Техника титрования Вычисления в титриметрическом анализе
Теоретические основы
При расчетах в аналитической химии используют в основном следующие способы выражения концентрации: 1. Массовая доля в процентах – отношение массы растворенного вещества к массе раствора.
2. Молярная концентрация – показывает, какое количество моль растворенного вещества содержится в 1 литре раствора. Обозначение См или 0,02М, то есть См-0,02 моль/л
где n – число моль вещества в данном объеме V – объем раствора в мл
где m – масса вещества в данном объеме раствора М – молярная масса вещества 3. Молярная концентрация эквивалента (нормальная концентрация) – показывает, какое количество эквивалентов вещества содержится в 1 литре раствора. Обозначается СN или N (н) 0,02N или 0,02н, то есть СN=0,02 моль/л (э/л) Переход от молярной концентрации к молярной концентрации эквивалента можно осуществлять по следующим формулам:
где f – фактор эквивалентности См – молярная концентрация N – молярная концентрация эквивалента
где M(э) – молярная масса эквивалента (эквивалентная масса) (г/моль) М – молярная масса (г/моль) 4. Титр – показывает, сколько граммов растворенного вещества содержится в 1 мл раствора. Обозначение Т; единицы измерения (г/моль). Переход от молярной концентрации эквивалента к титру осуществляется по формулам:
5. Титр по определяемому веществу (относительный титр) показывает, сколько граммов определяемого вещества взаимодействует с 1 мл раствора. Обозначение Трасторв/опр.вещ-во; единицы измерения (г/мл)
Пример
ТKOH/HCl = 0,0269 г/мл означает, что с 1 мл раствора КОН взаимодействует 0,0269 г НCl; единицы измерения (г/мл). Переход от молярной концентрации эквивалента к относительному титру осуществляется по формуле:
6. Поправочный коэффициент – отношение точной концентрации раствора к его теоретической концентрации
Примеры расчетов
1. Для 0,05N раствора К2СО3 вычислить: молярную концентрацию; титр и титр по азотной кислоте.
Алгоритм решения
2. Навеску 3,2816 г NaCl растворили в мерной колбе 500 мл. Определить молярную концентрацию эквивалента, нормальную концентрацию, титр раствора.
Алгоритм решения
3. Сколько миллилитров 0,2М раствора можно приготовить из 250 мл раствора НCl с титром 0,03646 г/мл?
Алгоритм решения
4. Определить титр КОН по Н2SO4 для 0,01N раствора КОН с поправочным коэффициентом 1,0264.
Алгоритм решения
|
||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 1546; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.118.149.55 (0.008 с.) |


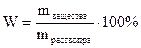
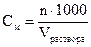

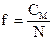
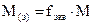
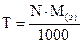 ;
; 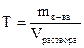
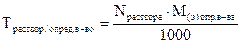

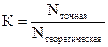
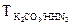


 2.
2. 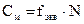
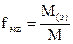
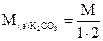
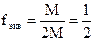
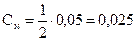 моль/л
3.
моль/л
3.  г/моль
г/моль
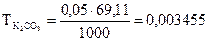 г/мл
4.
г/мл
4. 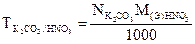
 г/моль
г/моль
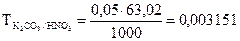 г/мл
г/мл
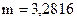 г
г
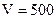 мл
--------------------------
мл
--------------------------
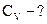
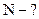
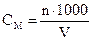 ;
; 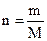
 г/моль
г/моль
 моль
моль
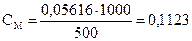 моль/л
3.
моль/л
3. 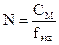 ;
; 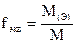
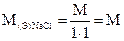 ;
; 
 моль/л
4.
моль/л
4. 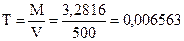 г/мл
г/мл
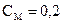 моль/л
моль/л
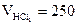 мл
мл
 г/мл
---------------------------
г/мл
---------------------------
 2.
2. 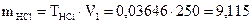 г
3.
г
3.  моль
моль
 г/моль
4.
г/моль
4. 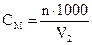
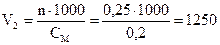 мл
мл
 моль/л
моль/л
 ---------------------------
---------------------------
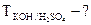 2.
2. 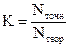
 моль/л
3.
моль/л
3. 
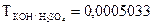 г/мл
г/мл
 г/моль
г/моль



