
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Молярная масса эквивалента окислителей и восстановителейСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Молярная масса эквивалента соответствует такому количеству вещества, которое соединяется с одним молем атомов водорода или замещает то же количество атомов водорода в химических реакциях. Для нахождения молярных масс эквивалента (Э) в реакциях окисления-восстановления необходимо мольную массу (М) окислителя или восстановителя разделить на число электронов, присоединяемых или отдаваемых в данной реакции одной молекулой реагирующих веществ:
где n – число электронов, присоединяемых или отдаваемых одной молекулой окислителя или восстановителя; М – мольная масса окислителя или восстановителя; М(Э) – молярная масса эквивалента.
Окислительно-восстановительные потенциалы (2)*. Кривые титрования (2)*. Индикаторы (2)*.
Перманганатометрия (2)*
Перманганатометрия является частным случаем титрования окислителя (оксидиметрия), в котором в качестве титранта применяют КМnO4. Окислительная способность КМnO4 зависит от рН среды. Ионы МnO4- восстанавливаются в разные продукты в соответствии со следующими реакциями: В сильнокислой среде:
Следовательно, Mn+7, входящий в состав перманганата, восстанавливается до бесцветных Mn+2 ионов, принимая 5 электронов отсюда: В нейтральной, слабокислой, и щелочной средах:
При окислении в нейтральной, слабокислой, щелочной средах Mn+7 восстанавливается до Mn+4, принимая 3 электрона с образованием марганцеватистой кислоты Н2MnO3 или MnO(OH)2 выпадает в виде бурого осадка, присутствие которого в растворе при титровании затрудняет определение точки эквивалентности. Кроме того, окислительная способность перманганата в щелочной и нейтральной средах ниже, чем в кислой. Поэтому титрование перманганатом восстановителей обычно проводят в кислой среде. Молярная масса эквивалента КМnO4 в нейтральной, слабокислой и щелочной средах составляет: Для сопоставления рассчитываем эквивалентную массу соли сульфата железа (II) в обменной реакции (без доступа воздуха).
Массовые отношения между веществами определяется числом участвующих в реакции зарядов, а не электронов. Тогда эквивалентная масса сульфата железа (II) составит: Таким образом, при расчете молярной массы эквивалента необходимо учитывать условия и химизм протекающей реакции.
Лабораторные работы
1. Стандартизация рабочего раствора перманганата калия по щавелевой кислоте. 2. Определение содержания железа (II) в растворе соли Мора.
Практическое занятие
1. Расчет молярной массы эквивалента окислителя и восстановителя.
|
|||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 1247; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.226.166.126 (0.007 с.) |




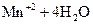
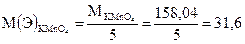 г/моль
г/моль

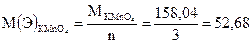 г/моль
г/моль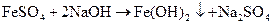
 г/моль
г/моль


