
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Дзержинский химический техникум имени красной армииСодержание книги
Поиск на нашем сайте
ФЕДЕРАЛЬНОЕ АГЕНТСТВО ПО ОБРАЗОВАНИЮ Государственное образовательное учреждение среднего профессионального образования
ДЗЕРЖИНСКИЙ ХИМИЧЕСКИЙ ТЕХНИКУМ ИМЕНИ КРАСНОЙ АРМИИ
АНАЛИТИЧЕСКАЯ ХИМИЯ Методические рекомендации для студентов-заочников образовательных учреждений среднего профессионального образования По специальностям Химическая технология органических веществ» Химическая технология неорганических веществ»
Дзержинск, 2005 Методические указания составлены в соответствии с примерной программой «Аналитическая химия» по дисциплине «Аналитическая химия» для специальностей 240401 «Химическая технология органических веществ» и 240301 «Химическая технология неорганических веществ». Москва, 2002.
Примерный тематический план
Введение
Программой дисциплины «Аналитическая химия» предусматривается изучение химических и физико-химических методов исследования состава вещества и овладение этими методами. Программа изучает разделы «Оценка достоверности аналитических данных», «Качественный анализ», «Количественный анализ», «Физико-химические методы анализа». Вопросы химического анализа излагаются на основе закона действия масс и периодического закона Д.И. Менделеева. В основу раздела «Качественный анализ» положена кислотно-щелочная классификация катионов, т.е. этот метод освобожден от многих недостатков, присущих сероводородному методу и может быть использован в лабораториях, не имеющих специально приспособленных помещений. К тому же он сохраняет принцип систематического хода анализа, что дает возможность на практике ознакомиться с реакциями осаждения, окисления-восстановления, а также с процессами растворения, гидрохимического расщепления, действием буферных растворов. Несмотря на то, что классические методы качественного анализа на практике заменяются физико-химическими методами анализа, практикум по качественному анализу имеет большое воспитательное значение, т.к. способствует развитию профессионального мышления, развивает такие качества, как аккуратность, наблюдательность, трудолюбие. В процессе проведения анализов необходимо привить учащимся умение тщательно выполнять работу, бережно относиться к приборам. Экономно расходовать реактивы, строго соблюдать правила техники безопасности, рационально использовать рабочее время. Все работы оформляются учащимися в лабораторном журнале в соответствии с требованиями ЕСТД. При оценке лабораторной работы учитывается техника ее выполнения, качество оформления в лабораторном журнале, точность результатов анализов. В результате изучения предмета учащиеся должны понять значение аналитической химии в развитии науки и техники, ее роль в разработке методов контроля производства, регулирования технологических процессов и управления ими; овладеть техникой проведения анализов, контрольных определений, освоить приемы работы с приборами и аппаратурой, применяемый для этих целей в практике заводских лабораторий, научиться самостоятельно определять показатели, характеризующие состав вещества, изучить правила техники безопасности. Для закрепления пройденного материала предусматривается проведение двух контрольных работ. В результате изучения дисциплины студент должен: иметь представление: - о значении химического анализа; - о методах качественного и количественного анализа; - о чувствительности и специфичности аналитических реакций; знать: - аналитическую классификацию ионов; - аппаратуру и технику выполнения анализов; - приемы безопасной работы в лаборатории; уметь: - анализировать вещество с соблюдением правил техники безопасности; - описать уравнениями химических реакций ход анализа (с использованием справочной литературы); - производить расчеты результатов анализа; - рассчитать абсолютную и относительную ошибку; - пользоваться справочной литературой.
Самостоятельная работа студентов
СОДЕРЖАНИЕ ДИСЦИПЛИНЫ Тема 1.1. Катионы
Студент должен: знать: - характеристику аналитических реакций; - виды реактивов; - аналитическую классификацию катионов; - действие групповых реактивов; уметь: - обнаружить катионы по заданию; - обосновать выбор и ход анализа катионов в соответствии с конкретным заданием; - обосновать уравнением химических реакций достоверность результатов анализа; - написание уравнения диссоциации комплексной соли; - дать название комплексной соли в соответствии с конкретным заданием.
Основные понятия качественного химического анализа. Аналитические реакции. Виды реактивов. Дробный и систематический анализ. Аналитическая классификация катионов. Аппаратура и техника выполнения качественного химического полумикроанализа. Комплексные соединения, их строение, номенклатура. Диссоциация комплексных соединений. Общая характеристика групп катионов. Групповые реактивы. Реакции окисления-восстановления.
Качественный анализ изучает качественный состав вещества, т.е. определяет, из каких элементов или ионов состоит данное вещество. Химический анализ может выполняться «сухим путем»: анализируют вещество, не растворяя, или «мокрым путем»: сначала исследуемое вещество растворяют, а затем определяют его состав. Аналитическая реакция – это такая реакция между ионами при которой происходит внешнее изменение (выпадение осадка, выделение газа, изменение окраски). Виды реактивов
Чувствительный реактив – это реактив, открывающий очень малую концентрацию ионов. Специфический реактив – это реактив, который открывает один ион в присутствии других ионов. Групповой – это реактив, который открывает группу ионов и позволяет отделить ее от других групп. Общеаналитический реактив – это реактив, который открывает несколько ионов, но не является групповым.
Классификация катионов
1. Сероводородная классификация – групповыми реактивами в основном являются соли сероводородной кислоты. 2. Кислотно-щелочная классификация – групповыми реактивами являются растворы кислот и щелочей.
Таблица 1 – Кислотно-щелочная классификация катионов
Комплексные соли
Комплексная соль – это сложное соединение в состав которого входит комплексный ион, он выделяется квадратными способами. Комплексная соль диссоциирует в растворе по двум ступеням. По первой ступени, как сильный электролит (диссоциация протекает необратимо) – на простой и комплексный ионы. По второй ступени, как слабый электролит, т.е. обратимо (комплексный ион диссоциирует на простые ионы).
Строение комплексных солей
Согласно координационной теории Вернера комплексная соль имеет следующее строение: 1. Комплексообразователь – катион металла (d-элемента в основном). 2. Лиганд (адденд) – отрицательно заряженные ионы или нейтрально-полярные молекулы (NH3, H2O), расположенные вокруг комплексообразователя. 3. Координационное число – это количество лигандов, расположенных вокруг комплексообразователя. 4. Внутренняя сфера состоит из комплексообразователя и лигандов и заключается в квадратные скобки. 5. Внешняя сфера состоит из простых ионов.
Лабораторные работы
1. Действие групповых реактивов на катионы II, III, VI групп. 2. Аналитические реакции катионов II, III, VI групп. 3. Анализ смеси катионов VI группы.
Тема 1.2. Анионы
Студент должен: знать: - аналитические реакции анионов; уметь: - обнаружить анионы.
Аналитическая классификация анионов. Общая характеристика. Характерные реакции на анионы.
В основе классификации лежит отношение анионов к групповым реактивам.
Таблица 2 – Классификация анионов
Лабораторная работа
1. Характерные реакции: хлорид-, бромид-, йодид-, карбонат-, сульфат-, сульфит-, нитрат-ионов.
Тема 1.3. Анализ солей
Студент должен: уметь: - провести анализ сухой соли, растворимой в воде.
Подготовка вещества к анализу. Методы проведения сухой соли в растворе. Предвари тельные испытания соли неизвестного состава, ход анализа.
Анализ соли
I. Предварительные испытания 1. Внешний осмотр (цвет, однородность, вид кристаллов) 2. Подготовка вещества к анализу (измельчение) 3. Окрашивание пламени 4. Испытание среды раствора с помощью индикатора II. Растворение Анализируемое вещество сначала пытаются растворить в дистиллированной воде на холоду, а затем при нагревании. Если вещество не растворилось, его растворяют на холоду в уксусной кислоте, а затем при нагревании в уксусной кислоте. Если вещество не растворилось, то растворяют в разбавленной азотной кислоте. Если вещество не растворилось, его растворяют в концентрированной азотной кислоте, а затем в царской водке. I. Растворение соли Несколько крупинок соли обрабатывают дистиллированной водой сначала на холоде, затем при нагревании (если в холодной воде соль не растворяется). III. Открытие катиона Выполняется с помощью характерных реакций, причем начинают открытие с того катиона, на который есть специфический реактив. IV. Удаление катиона Если катион не относится к VI группе, он мешает открытию аниона и его нужно удалить. Для этого раствор соли помещают в тигель, приливают избыток карбоната натрия, нагревают (не до кипения). При этом катион соли выпадает в осадок. Раствор с осадком приносят в центрифужную пробирку и центрифугируют. Осадок отбрасывают, а к раствору, который называют «содовой вытяжкой» приливают при нагревании уксусную кислоту до прекращения выделения пузырьков газа. Это необходимо для удаления из раствора избытка карбонат-ионов. Na2CO3 + CH3COOH ® Полученный раствор делят на три пробирки. VI. Открытие аниона Выполняют с помощью характерных реакций на анионы данной группы. Для исследования используют раствор, полученный в IV операции, находящийся в третьей пробирке (или раствор соли, если удаление катиона не проводилось). По окончании работы составляют формулу соли.
Лабораторная работа
1. Проведение анализа соли, растворимой в воде
Пример обработки результата
При обработке содержания меди получены следующие данные:
1) 2)
3) 4) 5) при 6)
Лабораторная работа
1. Определение влажности серного колчедана
Студент должен: произвести обработку результата анализа в лабораторной работе «Определение влажности серного колчедана»
I. Посуда общего назначения
1. Химический стакан 2. Плоскодонная колба 3. Коническая колба 4. Химическая воронка 5. Бюкс – для хранения твердых веществ, поглощающих влагу, взвешивания и высушивания твердых веществ 6. Тигель для прокаливания 7. Промывалка для хранения и использования небольшого количества воды (дистиллированной) и промывания осадка 8. Стеклянная палочка с резиновым наконечником
II. Специальная посуда
1. Эксикатор – для хранения и медленного охлаждения веществ, поглощающих влагу, а также для охлаждения бюкса и тиглей с веществом после высушивания или прокаливания. В нижней части эксикатора находится поглощающее влагу вещество.
III. Оборудование
1. Сушильный шкаф 2. Муфельная печь 3. Аналитические весы
Отбор средней пробы и подготовка вещества к анализу выполняется для того, чтобы состав анализируемой пробы соответствовал составу образца в целом.
Взятие навески. Массу навески обычно рассчитывают исходя из того, какую массу прокаленного осадка хотят получить: для аморфных осадков задают массу осадка 0,1-0,15 г; для кристаллических – 0,3-0,5 г. Максимальная навеска может быть 1-2 г.
Растворение. После взятия навески приступают к ее растворению (в воде или кислоте). Количество растворителя должно соответствовать концентрации раствора определяемого компонента: 0,5-1%. Навеску растворяют при слабом нагревании, не доводя до кипения во избежание разбрызгивания. Хорошо растворимое вещество растворяют без нагревания, на холоду.
Осаждение. Цель этого этапа гравиметрического анализа – количественный перевод определяемого компонента в определенное химическое соединение. По массе осадка можно рассчитать содержание определяемого компонента. Чем полнее выполнено осаждение, тем точнее результат анализа. Одна из причин, которые могут вызвать неполный переход в осадок определяемого компонента, связана с растворимостью осадка. Абсолютной полноты осаждения достичь нельзя, но можно уменьшить потери до нескольких сотых долей процента. Различают осаждаемую и весовую формы вещества. Осаждаемая – это то соединение, которое получают при действии осадителя. Осаждаемая форма должна быть: - менее растворимой, чтобы избежать потери при промывки; - крупнокристаллической; - легко переходить в весовую форму – это соединение, получаемое при прокаливании осаждаемой формы. Весовая форма должна быть: - устойчивой на воздухе; - иметь определенную формулу. Прежде выбирают осадитель. Осадитель выбирают исходя из следующих требований к нему: - он должен образовывать с анализируемым ионом менее растворимое соединение; - он должен быть летучим, чтобы полностью удалятся при прокаливании; - он должен быть специфическим реактивом, чтобы не осаждать примеси.
Пример выбора осадителя
Выбрать осадитель, для осаждения бария из раствора хлорида бария. 1) Выбирается осаждаемая форма по таблице
Таблица 4 – Концентрация вещества в растворе
В качестве осаждаемой формы выбираем сульфат бария, как наименее растворимое соединение, т.е. осадитель должен содержать сульфат ион. 2) выбирается осадитель. В качестве осадителя выбирается серная кислота, т.к. она более летуча. При осаждении берут избыток осадителя для уменьшения растворимости осадка в присутствии одноименного иона – обычно в 1,5-2 раза больше, чем необходимо. Для осаждения кристаллических осадков необходимы следующие условия: - осаждение проводят из горячих растворов (не кипятить); - перед осадителем в анализируемый раствор можно добавить кислоту, невзаимодействующую с анализируемым раствором и осадителем; - осаждение проводят, приливая осадитель к анализируемому раствору (не наоборот), тонкой струей, непрерывно помешивая стеклянной палочкой; - после осаждения раствор с осадком медленно охлаждают и оставляют на 5-6 часов для созревания осадка. После того, как раствор над осадком станет совершенно прозрачным, его проверяют на полноту осаждения: в раствор с отстоявшимся осадком осторожно, по стенке стакана приливают несколько капель осадителя. Если в месте попадания осадителя в раствор не образуется мути, значит, достигнуто полное осаждение.
Фильтрование и промывание. После полного осаждения необходимо тщательно отделить осадок от сопутствующих веществ. Для ведения процесса фильтрования используется фильтровальная бумага. Бумажные фильтры бывают зольные и беззольные (масса золы менее 0,0002 г.). По размеру фильтры бывают диаметром от 5 см до 18 см. Размер фильтра выбирают по объему фильтруемого осадка. Осадок должен занимать не более 1/3 конуса фильтра. Воронка выбирается по размеру фильтра, так чтобы фильтр не доходил до края воронки на 0,5 см. По плотности различают фильтры 3 сортов: 1. Черная или красная лента – наименьшей плотности для фильтрования аморфных осадков. 2. Белая лента – фильтры средней плотности для фильтрования крупнокристаллических осадков. 3. Синяя лента – наиболее плотные фильтры для фильтрования мелкокристаллических осадков. Существует 2 метода фильтрования. Первый метод заключается в перенесении осадка на фильтр, с последующей промывкой его на фильтре. Применяется в основном для крупнокристаллических осадков. Второй метод – декантация. Декантация - перенесение на фильтр только осветленной жидкости с последующей промывкой его в стакане. Применяется в основном для мелко кристаллических осадков.
Промывка осадка. Промывку осадка проводят небольшими порциями промывной жидкости 4-5 раз. В качестве промывной жидкости обычно используют дистиллированную воду, а если мало растворим, то горячую дистиллированную воду. Если осадок довольно хорошо растворим в воде, для понижения растворимости в воду добавляют электролит с одноименным ионом.
Проба на полноту промывки. Несколько капель фильтрата после четвертой промывки собирают в пробирку, приливают реактив на открываемый ион. Если мути не образуется, осадок промыт полностью. Если образуется муть, то осадок промывают еще раз.
Высушивание осадка. Влажный осадок, перенесенный на фильтр и промытый, содержит значительное количество воды. Фильтр с осадком подсушивают. Для количественного снятия осадка с фильтра в большинстве случаев фильтр сжигают, а осадок прокаливают. При сгорании беззольных фильтров образуется очень мало золы, а осадок или остается неизменным или количественно превращается в другое соединение. Существует несколько способов прокаливания, но во всех случаях его продолжают до тех пор, пока масса не станет различаться от предыдущей не более, чем на 0,0004 г. Тогда прокаливание считают законченным. Весьма распространенным источником ошибок является высокая гигроскопичность осадков после прокаливания. В целях защиты прокаленного осадка от контакта с влажным воздухом тигли с осадком охлаждают в специальных закрывающихся сосудах – эксикаторах, в которых содержатся высушиваемые вещества. Сразу после охлаждения до комнатной температуры осадок необходимо взвесить. Весы и взвешивание. Техника взвешивания
При взвешивании на демпферных весах необходимо соблюдать следующие правила: 1. Включать осветитель в сеть освещения при помощи шнура со штепсельной вилкой. 2. Регулировать положение нулевой точки. Для этого, не открывая дверок шкафа, осторожно поворачивают до отказа диск арретира. Автоматически загорающаяся лампочка освещает на экране вейтографа увеличенное изображение микрошкалы. Если весы не нагружены, нуль шкалы должен совпадать с вертикальной чертой на экране. Это совпадение достигается вращением в ту или иную сторону регулировочного винта, находящегося снаружи над диском арретира или с левой стороны. 3. На левую чашку весов помещают взвешиваемый предмет, а на правую – разновесы, масса которых составляет целое число граммов. 4. Закрывают дверцу шкафа. Для определения десятичных долей грамма при помощи внешнего диска. 5. Взвешивают вещество в бюксе, в тигле или на часовом стекле. Пример расчета процентного содержания вещества в анализируемом образце
Задача
При анализе нитрата алюминия массой 0,8105 г. получено 0,5008 г. оксида алюминия (III). Определить процентное содержание алюминия в нитрате алюминия (III).
Алгоритм решения
Лабораторная работа 1. Определение бария в растворе хлорида бария гравиметрическим методом.
Студент должен выполнить лабораторную работу «Определение бария в растворе хлорида бария», произвести расчет и оформить отчет по лабораторной работе.
Практические занятия
1. Расчет навески для приготовления растворов заданной концентрации 2. Решение задач на переход от одного способа выражения концентрации к другому.
Студент должен: знать: - классификацию методов титриметрического анализа; - способы приготовления стандартных растворов; - установочные вещества, требования к ним; уметь: - рассчитать навеску и концентрацию стандартных растворов; - проводить расчеты на переход от одного способа выражения концентрации к другому.
В титриметрическом анализе основной операцией является изменение объема двух взаимодействующих растворов, один из которых содержит анализируемое вещество, а концентрация второго заранее известна. Неизвестную концентрацию анализируемого раствора определяют, зная соотношение объемов реагирующих растворов и концентрацию одного из них. Для титриметрических определений можно использовать реакции различных типов, но все они должны удовлетворять следующим требованиям: 1. Реакция должна протекать по строго определенному стехиометрическому уравнению, побочные реакции должны быть исключены. 2. Так как при титровании нужно точно установить момент эквивалентности или фиксировать точку эквивалентности, конец реакции между растворами должен быть хорошо заметен по изменению окраски раствора или по появлению окрашенного осадка. Для установления точки эквивалентности при объемном анализе часто применяют индикатор. 3. Концентрация стандартного раствора должна быть точно известна. 4. Реакция между реагирующими веществами должна идти до конца и протекать быстро и количественно. Указанным выше требованиям удовлетворяют следующие реакции: 1. Реакция кислотно-основного взаимодействия. Метод, основанный на реакциях этого типа, называют методом кислотно-основного титрования. 2. Реакция окисления-восстановления, т.е. реакции, сопровождающиеся изменением степеней окисления (обмена электронами). Метод, основанный на реакциях этого типа, называют методом окислительно-восстановительного титрования (редоксометрия). 3. Реакция комплексообразования, т.е. реакции образования малодиссоциирующих комплексных соединений. Метод, основанный на реакциях этого типа, называют методом комплексометрического титрования. 4. Реакции осаждения, т.к. реакции образования малорастворимых электролитов. Метод, основанный на реакциях этого типа, называют методом осадительного титрования (седиметрия).
Способы титрования
В титриметрическом методе анализа используются 3 способа титрования: прямое, обратное и титрование заместителя. Прямое титрование – это титрование раствора определяемого вещества А непосредственно раствором титранта В. Его применяют в том случае, если реакция между А и В протекает быстро. Обратное титрование заключается в добавлении к определяемому веществу А избытка точно известного количества стандартного раствора В и после завершения реакции между ними, титровании оставшегося количества вещества В раствором титранта Титрование по заместителю. Если вещества А и В не взаимодействуют между собой, можно найти вещество С, которое при взаимодействии с веществом А выделяет эквивалентное количество вещества Д, которое взаимодействует с веществом В. По количеству выделенного вещества Д можно определить количество вещества А.
Мерная посуда
В титриметрическом анализе точного измерения объемов жидкости применяют мерную посуду: мерные колбы, пипетки и бюретки.
Техника титрования Теоретические основы
При расчетах в аналитической химии используют в основном следующие способы выражения концентрации: 1. Массовая доля в процентах – отношение массы растворенного вещества к массе раствора.
2. Молярная концентрация – показывает, какое количество моль растворенного вещества содержится в 1 литре раствора. Обозначение См или 0,02М, то есть См-0,02 моль/л
где n – число моль вещества в данном объеме V – объем раствора в мл
где m – масса вещества в данном объеме раствора М – молярная масса вещества 3. Молярная концентрация эквивалента (нормальная концентрация) – показывает, какое количество эквивалентов вещества содержится в 1 литре раствора. Обозначается СN или N (н) 0,02N или 0,02н, то есть СN=0,02 моль/л (э/л) Переход от молярной концентрации к молярной концентрации эквивалента можно осуществлять по следующим формулам:
где f – фактор эквивалентности См – молярная концентрация N – молярная концентрация эквивалента
где M(э) – молярная масса эквивалента (эквивалентная масса) (г/моль) М – молярная масса (г/моль) 4. Титр – показывает, сколько граммов растворенного вещества содержится в 1 мл раствора. Обозначение Т; единицы измерения (г/моль). Переход от молярной концентрации эквивалента к титру осуществляется по формулам:
5. Титр по определяемому веществу (относительный титр) показывает, сколько граммов определяемого вещества взаимодействует с 1 мл раствора. Обозначение Трасторв/опр.вещ-во; единицы измерения (г/мл)
Пример
ТKOH/HCl = 0,0269 г/мл означает, что с 1 мл раствора КОН взаимодействует 0,0269 г НCl; единицы измерения (г/мл). Переход от молярной концентрации эквивалента к относительному титру осуществляется по формуле:
6. Поправочный коэффициент – отношение точной концентрации раствора к его теоретической концентрации
Примеры расчетов
1. Для 0,05N раствора К2СО3 вычислить: молярную концентрацию; титр и титр по азотной кислоте.
Алгоритм решения
2. Навеску 3,2816 г NaCl растворили в мерной колбе 500 мл. Определить молярную концентрацию эквивалента, нормальную концентрацию, титр раствора.
Алгоритм решения
3. Сколько миллилитров 0,2М раствора можно приготовить из 250 мл раствора НCl с титром 0,03646 г/мл?
Алгоритм решения
4. Определить титр КОН по Н2SO4 для 0,01N раствора КОН с поправочным коэффициент
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 599; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.142.251.204 (0.012 с.) |


 ,
,  ,
, 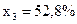 ,
, 
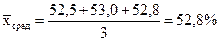






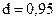 и
и  по таблице
по таблице 






 г
г
 г
------------------------------
г
------------------------------


 г
г
 %
%
 . Этот способ применяют в тех случаях, когда реакция между А и В протекает недостаточно быстро, либо нет подходящего индикатора для фиксирования точки эквивалентности этой реакции.
. Этот способ применяют в тех случаях, когда реакция между А и В протекает недостаточно быстро, либо нет подходящего индикатора для фиксирования точки эквивалентности этой реакции.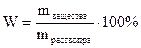
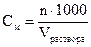

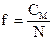
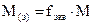
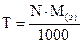 ;
; 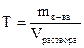
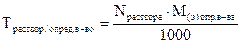

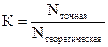
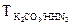


 2.
2. 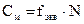
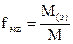
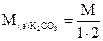
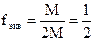
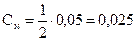 моль/л
3.
моль/л
3.  г/моль
г/моль
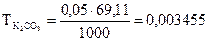 г/мл
4.
г/мл
4. 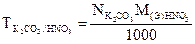
 г/моль
г/моль
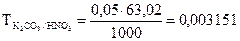 г/мл
г/мл
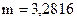 г
г
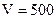 мл
--------------------------
мл
--------------------------
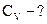
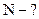
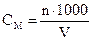 ;
; 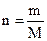
 г/моль
г/моль
 моль
моль
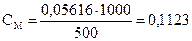 моль/л
3.
моль/л
3. 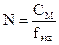 ;
; 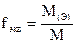
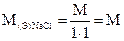 ;
; 
 моль/л
4.
моль/л
4. 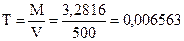 г/мл
г/мл
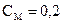 моль/л
моль/л
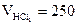 мл
мл
 г/мл
---------------------------
г/мл
---------------------------
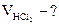 2.
2. 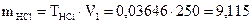 г
3.
г
3.  моль
моль
 г/моль
4.
г/моль
4. 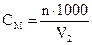
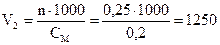 мл
мл



