
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Расчет процентного содержания вещества в анализируемом образцеСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Обычно в гравиметричском анализе требуется вычислить содержание определенного компонента в процентах. 1. Определяют фактор пересчета (F) (аналитический множитель) – это отношение атомной или молекулярный массы определяемого вещества к молекулярной массе прокаленного осадка. Фактор пересчета показывает, сколько граммов определяемого вещества содержится в 1 г. осадка.
При определении фактора пересчета (F) число атомных масс определяемого вещества в числителе и знаменателе должно быть одинаково.
Пример определения фактора пересчета
2. Находят массу определяемого вещества в прокаленном осадке.
3. Находят процентное содержание вещества в анализируемом образце
Пример расчета процентного содержания вещества в анализируемом образце
Задача
При анализе нитрата алюминия массой 0,8105 г. получено 0,5008 г. оксида алюминия (III). Определить процентное содержание алюминия в нитрате алюминия (III).
Алгоритм решения
Лабораторная работа 1. Определение бария в растворе хлорида бария гравиметрическим методом.
Студент должен выполнить лабораторную работу «Определение бария в растворе хлорида бария», произвести расчет и оформить отчет по лабораторной работе.
Тема 3.2. Титриметрический анализ
Классификация методов титриметрического анализа. Методы установления точки эквивалентности. Реакции титриметрического анализа. Способы приготовления стандартных растворов (с установленной и приготовленной концентрацией). Установочные вещества, требования к ним. Приемы титрования. Способы титрования. Способы выражения концентрации растворов в титриметрическом анализе. Нормальная концентрация, титр, относительный титр, поправочный коэффициент.
Практические занятия
1. Расчет навески для приготовления растворов заданной концентрации 2. Решение задач на переход от одного способа выражения концентрации к другому.
Студент должен: знать: - классификацию методов титриметрического анализа; - способы приготовления стандартных растворов; - установочные вещества, требования к ним; уметь: - рассчитать навеску и концентрацию стандартных растворов; - проводить расчеты на переход от одного способа выражения концентрации к другому.
В титриметрическом анализе основной операцией является изменение объема двух взаимодействующих растворов, один из которых содержит анализируемое вещество, а концентрация второго заранее известна. Неизвестную концентрацию анализируемого раствора определяют, зная соотношение объемов реагирующих растворов и концентрацию одного из них. Для титриметрических определений можно использовать реакции различных типов, но все они должны удовлетворять следующим требованиям: 1. Реакция должна протекать по строго определенному стехиометрическому уравнению, побочные реакции должны быть исключены. 2. Так как при титровании нужно точно установить момент эквивалентности или фиксировать точку эквивалентности, конец реакции между растворами должен быть хорошо заметен по изменению окраски раствора или по появлению окрашенного осадка. Для установления точки эквивалентности при объемном анализе часто применяют индикатор. 3. Концентрация стандартного раствора должна быть точно известна. 4. Реакция между реагирующими веществами должна идти до конца и протекать быстро и количественно. Указанным выше требованиям удовлетворяют следующие реакции: 1. Реакция кислотно-основного взаимодействия. Метод, основанный на реакциях этого типа, называют методом кислотно-основного титрования. 2. Реакция окисления-восстановления, т.е. реакции, сопровождающиеся изменением степеней окисления (обмена электронами). Метод, основанный на реакциях этого типа, называют методом окислительно-восстановительного титрования (редоксометрия). 3. Реакция комплексообразования, т.е. реакции образования малодиссоциирующих комплексных соединений. Метод, основанный на реакциях этого типа, называют методом комплексометрического титрования. 4. Реакции осаждения, т.к. реакции образования малорастворимых электролитов. Метод, основанный на реакциях этого типа, называют методом осадительного титрования (седиметрия).
Способы титрования
В титриметрическом методе анализа используются 3 способа титрования: прямое, обратное и титрование заместителя. Прямое титрование – это титрование раствора определяемого вещества А непосредственно раствором титранта В. Его применяют в том случае, если реакция между А и В протекает быстро. Обратное титрование заключается в добавлении к определяемому веществу А избытка точно известного количества стандартного раствора В и после завершения реакции между ними, титровании оставшегося количества вещества В раствором титранта Титрование по заместителю. Если вещества А и В не взаимодействуют между собой, можно найти вещество С, которое при взаимодействии с веществом А выделяет эквивалентное количество вещества Д, которое взаимодействует с веществом В. По количеству выделенного вещества Д можно определить количество вещества А.
Мерная посуда
В титриметрическом анализе точного измерения объемов жидкости применяют мерную посуду: мерные колбы, пипетки и бюретки.
|
||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 1886; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.57 (0.008 с.) |

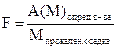
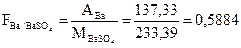
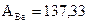 г/моль
г/моль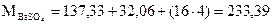 г/моль
г/моль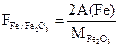
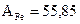 г/моль
г/моль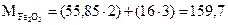 г/моль
г/моль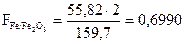
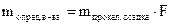
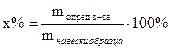
 г
г
 г
------------------------------
г
------------------------------


 г
г
 %
%
 . Этот способ применяют в тех случаях, когда реакция между А и В протекает недостаточно быстро, либо нет подходящего индикатора для фиксирования точки эквивалентности этой реакции.
. Этот способ применяют в тех случаях, когда реакция между А и В протекает недостаточно быстро, либо нет подходящего индикатора для фиксирования точки эквивалентности этой реакции.


