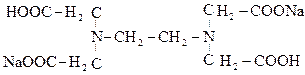Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Тема 3.2.3. Метод комплексонометрииСодержание книги
Поиск на нашем сайте
Сущность метода. Трилонометрия. Металлы-индикаторы.
Студент должен: знать: - сущность метода трилонометрии: - условия трилонометрического анализа; уметь: - определить содержание соли двухвалентного металла в растворе.
Комплексообразование основано на том, что вещесто, содержащееся в стандартном растворе, образует в анализируемым катионом прочное комплексное соединение, растворимое в воде. Хотя в ходе титрования осадок не образуется, концентрация определяемого иона по мере титрования уменьшается, так как все большее количество его связывается в комплекс. В этом отношении процесс комплексообразования аналогичен процессу осаждения. Осаждение происходит тем полнее, чем меньше растворимость осадка. Связывание определяемого иона в комплекс тем полнее, чем прочнее этот комплекс, т.е. чем меньше константа его нестойкости. Для химического анализа широко применяют тгруппы органических реактивов, объединенных под общим названием «комплексоны». Большинство комплексонов – производные аминодиуксусной кислоты. Наиболее широко применяется комплексон, называемый трилон Б, из которого приготовляют стандартный раствор для титрования методом комплексонометрии. Трилон Б – кислая двунатриевая соль этиленодиаминтетрауксусной кислоты (Na2H2Tr).
Трилон Б, как и другие комплексоны, образует прочные растворимые в воде комплексные соединения с ионами магния, щелочноземельных металлов, марганца, редкоземельных и других металлов. При комплексообразовании ион металла замещает ион водорода в карбоксильных группах комплексона и связывается координационно с атомами азота. Процесс образования комплекса можно представить уравнением реакции:
Чтобы сдвинуть равновесие в сторону образования комплекса, следует связывать ионы водорода. Этого достигают, добавляя аммиачный буферный раствор (NH4OH + NH4Cl), обеспечивающий достаточно высокое значение рН раствора. Индикаторами в комплексонометрии служат органические реактивы, которые дают с определяемым ионом характерно окрашенные соединения. Их цвет резко отличается от цвета раствора самого индикатора. Вблизи точки эквивалентности, когда почти все определяемые катионы связаны трилоном Б в комплекс, т.е. когда концентрация определяемых ионов резко уменьшается, окраска раствора меняется. В комплексонометрии применяют индикаторы, дающие окрашенной соединение с определяемым ионом. Примером такого индикатора служит эриохром черный Т (кислотный хром черный специальный), который с ионами магния, кальция и некоторыми другими образует комплексы, интенсивно окрашенные в винно-красный цвет. Раствор несвязанного в комплекс индикатора окрашен в синий цвет. Переход окраски от винно-красной и синей отчетлив, поэтому эриохром черный Т является чувствительным индикатором.
Лабораторная работа 1. Определение нитрата магния в растворе
|
||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 1110; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.144.38.184 (0.006 с.) |