
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Тема 4. 4. Потенциометрический метод анализаСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Теоретические основы метода. Потенциал электрода. Виды электродов. Кривые потенциометрического титрования. рН-метр.
Студент должен: знать: - сущность потенциометрического метода анализа.
Потенциометрический метод, основанный на измерении потенциала электрода, погруженного в раствор исследуемого вещества. Потенциал электрода зависит от концентрации соответствующих ионов в растворе при постоянных условиях измерений, которые проводят с помощью приборов – потенциометров. Для определения конечной точки или точки эквивалентности в кислотно-основном титровании достаточно следить только за концентрацией Н+-ионов. Для этой цели могут быть использованы различные электроды: водородный, сурьмяный, стеклянный. Такой индикаторный электрод заменяет индикатор при обычном титровании. Потенциал этих электродов в данном методе является функций концентрации Н+-ионов. Он устанавливается быстро и не зависит от присутствия других ионов в растворе, которые не принимают участие в осуществляемой химической реакции.
Потенциометрическое титрование
Для проведения потенциометрического титрования собирают установку, которая включает источник тока, потенциометр (или рН-метр), гальваническую цепь из двух электродов – сравнительного и индикаторного, магнитную мешалку, бюретку сос стандартным раствором и стакан с исследуемым раствором. Современные потенциометры дают возможность проводить отсчет ЭДС в милливольтах, или непосредственно определять значение рН. Единица рН соответствует при комнатной температуре 59,1 мВ. В соответствии с инструкцией потенциометр приводят в рабочее состояние, стакан заполняют исследуемым раствором и включают мешалку. После каждого прибавления стандартного раствора фиксируют ЭДС или рН.
Контрольная работа № 1 Вариант 1
а) Назовите комплексные соединения и укажите: лиганд, комплексообразователь, диссоциацию первой и второй ступени.
б) Определить содержание серы в 0,5854 г прокаленного осадка сульфата бария. в) Из навески 0,1 г сплава получено 0,1196 г осадка хлорида серебра. Вычислить процентное содержание серебра в сплаве.
Вариант 2
а) Назовите комплексные соединения и укажите: лиганд, комплексообразователь, диссоциацию первой и второй ступени.
б) Определить содержание кальция в осадке сульфата кальция массой 0,8253. в) При анализе сульфата железа (III) массой 0,3201 г получено 0,1161 г осадка оксида железа (III). Определить процентное содержание железа в сульфате железа (III).
Вариант 3
а) Назовите комплексные соединения и укажите: лиганд, комплексообразователь, диссоциацию первой и второй ступени.
б) Определить содержание калия в осадке сульфата калия массой 0,1941 г. в) При анализе нитрата серебра (I) массой 0,9604 г получено осадка хлорида серебра (I) 0,6208 г. Определить процентное содержание серебра в нитрате серебра (I).
Вариант 4
а) Назовите комплексные соединения и укажите: лиганд, комплексообразователь, диссоциацию первой и второй ступени.
б) Определить содержание алюминия в осадке оксида алюминия (III) массой 0,5962 г. в) Из навески массой 0,528 г
Вариант 5
а) Назовите комплексные соединения и укажите: лиганд, комплексообразователь, диссоциацию первой и второй ступени.
б) Определить содержание натрия в осадке сульфата натрия массой 0,7612 г. в) Для анализа образца технического хлорида бария взята навеска 0,6878 г. Из нее получено 0,6556 г сульфата бария. Вычислить процентное содержание бария в техническом хлориде бария.
Вариант 6
а) Назовите комплексные соединения и укажите: лиганд, комплексообразователь, диссоциацию первой и второй ступени.
б) Определить содержание оксида серебра (I) в осадке хлорида серебра массой 0,9820 г. в) При анализе 0,7810 г сплава получено 0,3028 г осадка оксида железа (III). Определить процентное содержание железа в сплаве.
Вариант 7
а) Назовите комплексные соединения и укажите: лиганд, комплексообразователь, диссоциацию первой и второй ступени.
б) Определить содержание натрия в осадке хлорида натрия массой 0,4832 г. в) Из образца технического сульфата цинка массой 2,7814 г получено 0,9380 г осадка
Вариант 8
а) Назовите комплексные соединения и укажите: лиганд, комплексообразователь, диссоциацию первой и второй ступени.
б) Определить содержание калия в осадке карбоната калия массой 0,5172 г. в) Из навески 0,1 г сплава получено 0,02615 г осадка хлорида серебра. Определить процентное содержание в сплаве оксида серебра.
Вариант 9
а) Назовите комплексные соединения и укажите: лиганд, комплексообразователь, диссоциацию первой и второй ступени.
б) Определить содержание серебра (I) в осадке сульфата серебра массой 0,3248 г. в) Из навески 0,15 г сплава получено 0,03515 г осадка хлорида серебра. Определить процентное содержание в сплаве серебра.
Вариант 10
а) Назовите комплексные соединения и укажите: лиганд, комплексообразователь, диссоциацию первой и второй ступени.
б) Определить содержание серебра (I) в осадке сульфида серебра (I) массой 0,45525 г. в) Для анализа образца хлорида натрия взята навеска 0,8768 г. Из нее получено 0,4605 г сульфата натрия. Вычислить процентное содержание натрия в хлориде натрия.
Контрольная работа № 2
Вариант 1
а) Поправочный коэффициент К 0,1N раствору серной кислоты равен 0,928. Определить титр раствора серной кислоты. б) Определите нормальную концентрацию 0,4М раствора хлорида хрома (III). в) На титрование 20 мл раствора гидроксида калия с
Вариант 2
а) Определить молярную концентрацию 0,4N раствора сульфата кальция (II). б) Поправочный коэффициент к 0,5N раствору соляной кислоты равен 1,1800. Определить титр раствора соляной кислоты. в) На титрование 20 мл раствора гидроксида натрия израсходовано 19,1 мл раствора серной кислоты с
Вариант 3
а) Определить титр гидроксида натрия по азотной кислоте для 0,1N раствора гидроксида натрия с поправочным коэффициентом 1,0264? б) На титрование 15 мл гидроксида натрия требуется 17,8 мл раствора азотной кислоты с титром 0,0782 г/мл. Определить титр гидроксида натрия. в) Определить нормальную концентрацию и титр 0,6М раствора нитрата цинка (II).
Вариант 4
а) Определить титр гидроксида калия по серной кислоте для 0,01N раствора гидроксида калия с поправочным коэффициентом 1,0312? б) На титрование 10 мл раствора азотной кислоты требуется 11,2 мл 0,5N раствора гидроксида калия. Определить нормальную концентрацию азотной кислоты. в) Определить молярную концентрацию 0,06N раствора карбоната натрия?
Вариант 5
а) Определить молярную концентрацию 0,9N раствора нитрата кальция? б) На титрование 25 мл раствора уксусной кислоты требуется 22,6 мл 0,01N раствора карбоната калия. Определить нормальную концентрацию раствора уксусной кислоты. в) Сколько граммов гидроксида натрия требуется для приготовления 100 мл 0,3 N раствора?
Вариант 6
а) На титрование 25 мл раствора гидроксида аммония требуется 23,3 мл 0,2N раствора соляной кислоты. Сколько граммов гидроксида аммония содержится в объеме мерной колбы 200 мл? б) Определить титр раствора хлороводородной кислоты и титр хлороводородной кислоты по гидроксиду натрия, если нормальная концентрация раствора равняется 0,6834 э/л. в) Определить молярную концентрацию 0,2N раствора серной кислоты.
Вариант 7
а) Сколько граммов щавелевой кислоты б) Поправочный коэффициент к 0,2N раствору азотной кислоты равен 0,892. Определить титр азотной кислоты? в) На титрование 10 мл раствора азотной кислоты требуется 11,2 мл 0,5N раствора гидроксида калия. Определить нормальную концентрацию и титр раствора азотной кислоты?
Вариант 8
а) Из навески хлорида алюминия (III) массой 4 г приготовлено 250 мл раствора. Определить нормальную концентрацию раствора? б) Титр гидроксида аммония равен 0,007218 г/мл. Определить нормальную и молярную концентрации. в) На титрование 10 мл раствора гидроксида аммония требуется 11,8 мл раствора соляной кислоты с титром 0,00731 г/мл. Определить нормальную концентрацию гидроксида аммония.
Вариант 9
а) На титрование 5 мл раствора соляной кислоты требуется 7,2 мл раствора гидроксида калия с титром 0,0224 г/мл. Определить нормальную концентрацию раствора соляной кислоты. б) Из навески карбоната натрия массой 2 г приготовлено 200 мл раствора. Определить нормальную концентрацию раствора. в)
Вариант 10
а) Сколько граммов щавелевой кислоты б) Определить молярную концентрацию 0,2N раствора хлорида натрия. в) На титрование 25 мл раствора хлороводородной кислоты с
Рекомендуемая литература
1. Шапиро М.А., Шапиро С.А. Аналитическая химия. – М: Высшая школа, 1979. 2. Ольшанова М.К., Пискарева С.К., Барашкова К.М. Аналитическая химия. – М: Химия, 1990. 3. Аналитическая химия / под ред. профессора Л.А. Ищенко. – М: Академия, 2004.
Дополнительная литература
1. Крешков А.П., Ярославцев А.А. Курс аналитической химии. ч.1. Качественный анализ. – М: Химия, 1981. 2. Крешков А.П., Ярославцев А.А. Курс аналитической химии. ч.2. Количественный анализ. – М: Химия, 1982. 3. Ярославцев А.А. Сборник задач и упражнение по аналитической химии. – М: Высшая школа, 1979. 4. Васильев В.П., Кочергина Л.А. и др. Аналитическая химия сборник вопросов, упражнений и задач. – М: Дрофа, 2003.
* - учебник
|
||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 963; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.119 (0.006 с.) |

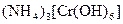 ;
; 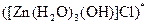 ;
; 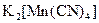 .
.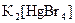 ;
; 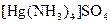 ;
; 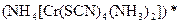
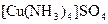 ;
; 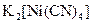 ;
; 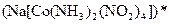
 ;
;  ;
; 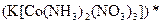
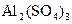 получено 0,155 г осадка
получено 0,155 г осадка 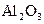 . Определить процентное содержание алюминия в сульфате алюминия (III).
. Определить процентное содержание алюминия в сульфате алюминия (III).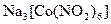 ;
;  ;
; 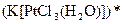
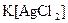 ;
; 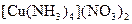 ;
; 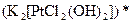
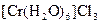 ;
; 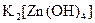 ;
; 
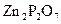 . Определить процентное содержание цинка в сульфате цинка.
. Определить процентное содержание цинка в сульфате цинка. ;
; 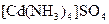 ;
; 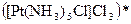
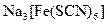 ;
; 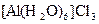 ;
; 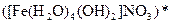
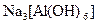 ;
; 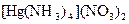 ;
; 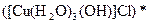
 г/мл расходуется 18,4 мл раствора серной кислоты. Определить нормальную концентрацию серной кислоты.
г/мл расходуется 18,4 мл раствора серной кислоты. Определить нормальную концентрацию серной кислоты.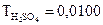 г/мл. Определить нормальную концентрацию гидроксида натрия.
г/мл. Определить нормальную концентрацию гидроксида натрия. требуется для приготовления 500 мл 0,04N раствора?
требуется для приготовления 500 мл 0,04N раствора?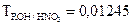 г/мл. Определить нормальную концентрацию и молярную концентрацию.
г/мл. Определить нормальную концентрацию и молярную концентрацию.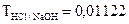 г/мл расходуется 25,82 мл раствора гидроксида натрия. Определить нормальность раствора гидроксида натрия.
г/мл расходуется 25,82 мл раствора гидроксида натрия. Определить нормальность раствора гидроксида натрия.


