
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Анализ плоскостной хроматограммыСодержание книги
Поиск на нашем сайте
Разделяемые компоненты образуют на хроматографической пластинке или полоске хроматографической бумаги отдельные зоны (пятна). Положение отдельных хроматографических зон на хроматограмме характеризуют с помощью величины Rf, равной отношению расстояния, пройденного зоной вещества от стартовой линии до центра зоны (x), к расстоянию от стартовой линии до границы фронта растворителя к концу опыта (L):Rf= Х/L Подвижность разделяемых веществ можно также сравнить с подвижностью вещества, принятого за стандарт:
Рассчитывают коэффициент разделения (α) и разрешение (RS) (см вопр 61) Плоскостная хроматография используется, главным образом,для обнаружения и идентификации веществ.
95. Понятие о гибридных методах анализа. Масс-спектроскопия. Хромато-масс-спектроскопия. Масс-спектрометрия — метод исследования вещ-ва путём определения отношения массы к заряду и кол-ва заряженных частиц, обр.при том или ином процессе воздействия на вещество. Масс-спектрометры -приборы для разделения ионизированных частиц вещества (молекул, атомов) по их массам, основанные на воздействии магнитных и электр.полей на пучки ионов, летящих в вакууме. В масс-спектрометрах регистрация ионов осуществляется электр. методами, в масс-спектрографах — по потемнению чувствительного слоя фотопластинки, помещаемой в прибор. Масс-спектрометры имеют широкий динамический диапазон: от 5-6 порядков для анализа вещества орг.природы до 9-10 порядков для элементного анализа вещ-в. Масс-спектрометр обычно сод. устройство для подготовки исследуемого вещ-ва; ионный источник, где это вещество частично ионизуется и происходит формирование ионного пучка; масс-анализатор, в котором происходит разделение ионов по массам, приёмник ионов, где ионный ток преобразуется в электрический сигнал, который затем усиливается и регистрируется. В регистрирующее устройство, помимо информации о количестве, из анализатора поступает также информация о массе ионов. Масс-спектрометр содержит также системы электрического питания и устройства, создающие и поддерживающие высокий вакуум в ионном источнике и анализаторе. Масс-спектр - это зависимость интенсивности ионного тока от отношения массы к заряду. Каждый из пиков ионного тока соответствует однозарядным ионам изотопов. Отношение массы иона к ширине m пика (в единицах массы) Различают статические ( используются электрические и магнитные поля )и динамические ( для разделения ионов с разными m/е используют разные времена пролёта ионами опр.расстояния) масс-спектрометры. Хромато-масс-спектрометрия. Метод анализа смесей и определения следовых количеств веществ в объеме жидкости. Метод основан на комбинации двух самостоятельных методов – хроматографии и масс-спектрометрии. С помощью первого осуществляют разделение смеси на компоненты, с помощью второго -идентификацию и определение строения вещества, количественный анализ. Хромато-масс-спектометр включает три основные части: хроматограф (обычно газовый или жидкостный), масс-спектометр и интерфейс – специфический узел, обеспечивающий соединение и совместную работу хроматографических и масс-спектрометрических приборов. Газовый поток из хроматографической колонки через первую форсунку со сверхзвуковой скоростью попадает в область вакуума, где молекулы распростр. со скоростями, обратно пропорциональными их массе. В результате более легкие и быстрые молекулы газа-носителя откачиваются насосом, а более медленные мол. орг. вещ-ва попадают в отверстие второй форсунки, а затем в ионный источник масс-спектрометра. Некоторые приборы снабжены двухстадийным мол. сепаратором, снабженным еще одним подобным блоком форсунок. В объеме между ними созд. высокий вакуум. Чем легче мол. газа-носителя, тем эффективнее они удал.из газ. потока и тем выше обогащение орг. вещ-вом. Наиб. удобный газ-носитель - гелий. 96. Общая характеристика электрохимических методов. 1. Методы, связанные с электродными реакциями: а)с применением пост. факторов возбуждения (потенциометрия, кулонометрия, электрогравиметрия) б)с применением переменных факторов возбуждения(вольтамперометрия) 2.Методы,в кот. не должны приниматься во внимание ни двойной электр. слой,ни какие-либо эектрон. реакции 3. Методы, связанные с явлениями в двойном электр. слое, но для кот. не должны приниматься во внимание никакие электродные р-ции 4.прямые(используется зависимость электрического параметра от концентрации вещества) 5.косвенные(изменение величины электрического параметра используется для обнаружения конечной точки титрования) 97. Электрохимические методы анализа. Характеристика электродов и принцип работы электрохимической ячейки. Поляризация электродов. Ячейки первого типа называются ячейками без жидкостного соединения, второго типа - ячейками с жидкостным соединением. В сост. электрохим. ячейки должно входить, по крайней мере, два электрода: индикаторный электрод и электрод сравнения. На практике в качестве электродов сравнения чаще всего применяют хлоридсеребряный и каломельный электроды. В состав электрохимической ячейки может входить ещё и третий электрод - вспомогательный. Этот электрод служит источником электронов или играет роль стока электронов,обеспечивая возможность протекания электр. тока через ячейку. Если во внешней цепи начинает протекать электр. ток, то это приводит к отклонению величины потенциала электрода.Такое явление называется поляризацией, а электрод - поляризованным. Концентрационная поляризация возникает вследствие медл. диффузии вещества из объёма р-ра к поверхности электрода и приводит к уменьш. потенциала электрода. Для уменьш. концентрационной поляризации, анализируемый раствор пост. перемешивают. Кинетическая поляризация, или перенапряжение обусловлена медленным переносом электронов на поверхности электродов. Величина кинетической поляризации зависит от природы окислительно-восст. сис-мы и материала электрода. 98. Кондуктометрический метод анализа. Теоретические основы. Измерение аналитического сигнала. Кондуктометрическое титрование. Понятие о высокочастотной кондуктометрии. Кондуктометрия - это сов-ть электрохим. методов анализа, основанных на измер. удельной электропроводности растворов электролитов. Любое вещ-во характер. своим электр. сопротивлением (R-{Ом}). Величина обратная сопротивлению называется электропроводностью или электрической проводимостью (G-{См}). Для раствора электролита, находящегося между двумя электродами, площадь поверхности которых равна S и расстояние между которыми равно l:
Удельная электропроводность Удельная электропроводность связана с молярной концентрацией эквивалента вещества (моль/л): K = 1/ρ
Измерение аналитического сигнала. Контактные кондуктометрические измерения проводят в ячейке для измерения электропроводности. Простейшая ячейка предст. собой стеклян.сосуд с двумя плоскопараллел. платиновыми электродами. Раствор,находящийся в ячейке, постоянно перемешивается. Ячейку подключают к источнику переменного тока с частотой около 1000 Гц. Непосредственно измеряемой величиной в кондуктометрии является не электропроводность, а сопротивление.Сопротивление р-ра можно измерять с пом. моста Уитстона. Мосты переменного тока могут быть уравновешенными и неуравновешенными. В случае уравновешенного моста величины сопротивлений R1, R2 и R3 должны быть такими, чтобы мост пришёл в состояние равновесия, при котором сила тока в измерительной диагонали равна нулю (или имеет минимальное значение). Измерить с удовлетвори тельной точностью величины и S трудно, поэтому вначале измеряют сопротивление раствора, удельная электропроводность которого точно известна. В качестве такого стандарта используется раствор KCl. Кондуктометрическое титрование основано на изменении удельной электропроводности раствора в зависимости от количества добавленного титранта. Точку эквивалентности опр. по изменению электропроводности раствора. Электропроводность измеряют после добавл.каждой порции титранта. Зависимость электропров. от кол-ва добавлен. титранта наз. кривой кондуктометрического титрования. Они имеют излом, соответствующий точке эквивалентности. Преимущество метода- возможность определения вещ-в в многокомпонентных смесях в водных растворах.
Понятие о высокочастотной кондуктометрии. Используется электр. ток высокой частоты. Электроды в ячейках для высокочаст. титрования не соприкасаются с анализир. р.р-ром. Сущ. два типа таких ячеек: емкостная (измеряют измен. частоты генератора в процессе титрования) и индуктивная (помещ. внутрь электромагн.катушки). 99. Кулонометрический метод анализа. Общая характеристика. Прямая кулонометрия. Практическое применение. Массу определяемого вещества при кулонометрических определениях рассчитывают непосредственно из количества пропущенного электричества (в кулонах). В основе кулонометрии лежат законы Фарадея для электролиза. Объединенный закон Фарадея: Количество вещества, выделенного на электродах, прямо пропорционально количеству прошедшего электричества и молярной массе эквивалента вещества: m = (M/nF)•Q, где m – масса вещества, окисленного (восстановленного) в процессе электролиза; M – молярная масса вещества; n – число электронов, участвующих в электродной реакции; F – постоянная Фарадея (F = 96487 Кл/моль 9,65104 Кл/моль), Q – количество электричества,Кл. - Необходимо, чтобы отсутствовали побочные химические и электрохимические процессы, т.е. выход по току должен быть равен 100% - определяемый элемент окислителя (восстанавливался) только до одной точно известной степени окисления - был известен способ определения количества электричества или момента завершения реакции. Прямая кулонометрия - используется для определения соединений Cu, Au, Ag, Tl, Sb и других элементов, а также для хинонов и гидрохинонов, многоатомных фенолов, нитро-, нитрозо- и азосоединений, галогенопроизводных и т.д. Прямые кулонометрические определения обычно проводят при постоянном потенциале. Прямая кулонометрия при постоянной силе тока используется в тех случаях, когда определяемое вещество находится на поверхности электрода или предварительно выделено на этой поверхности. 100. Кулонометрический метод анализа. Кулонометрической титрование. Практическое применение. - титрант не нужно готовить, стандартизировать и хранить; - можно получать титранты (например, Fe2+ или Cl2), которые сложно или невозможно приготовить обычным способом; - титрант легче «дозируется» (отрегулировать силу тока значительно легче, чем добавить точный объём титранта); - раствор в процессе титрования не разбавляется; - в процессе предэлектролиза можно устранить мешающее влияние примесей; - одну и ту же ячейку можно использовать для любого вида титрования; - процесс анализа можно легко автоматизировать. 101. Потенциометрический метод анализа. Принцип работы и основные характеристики ион-селективных электродов. - сила тока, протекающего через ячейку, должна быть равна 0; - время, в течение которого проводится измерение, должно быть достаточным для достижения равновесия. При измерении ЭДС в таких условиях можно считать, что величина соотношения аокисл/ aвосст у поверхности электрода равна величине этого соотношения в растворе. Методы измерения ЭДС: компенсационный (Используют потенциометр Погендорфа) и некомпенсационный (Используют электронный вольтметр с очень большим входным сопротивлением). Приборы, позволяющие определять величину рХ (отрицательного логарифма активности иона Х в растворе), в комплекте с соответствующими ионо-селективными электродами, называются иономерами. Если прибор предназначен для измерения активности только катионов водорода, то его называют рН-метром. Индикаторные электроды – металлические (имеют электронную проводимость) и неметаллические (имеют ионную проводимость). Ионоселективные электроды – это чувствительные элементы, потенциалы которых линейно зависят от lg активности определяемого иона в растворе. В состав ионоселективных электродов входит полупроницаемая мембрана, представляющая собой тонкую плёнку, отделяющую внутренний раствор (стандартный) от внешнего (анализируемого) и способную пропускать преимущественно ионы только одного вида. Основные характеристики: интервал выполнения электродной функции, время отклика (Время, за которое потенциал электрода достигает постоянного значения. Чем меньше время отклика, тем лучше электрод) и селективность (Определяется потенциометрическим коэффициентом селективности, отражающим относительное влияние ионов А и В на величину мембранного потенциала. Чем меньше его величина, тем выше селективность электрода относительно иона А). Виды ион-селективных электродов: - с кристаллическими мембранами - с жесткой матрицей (стеклянные, имеют стеклянную мембрану обладающую селективностью по отношению к определённому иону) - с подвижными носителями (имеют жидкую мембрану - раствор ионообменника или "нейтрального переносчика" в органическом растворителе, удерживаемый на пористом полимереили заключённыйв полимернуюматрицу) - газочувствительные (датчики, состоящие из индикаторного электрода и электрода сравнения и имеющие газопроницаемую мембрану или воздушный зазор для отделения анализируемого раствора от тонкой плёнки промежуточного раствора электролита) - ферментные (датчики, в которых ИСЭ покрыт плёнкой, содержащей фермент, способный вызвать реакцию превращения субстрата с образованием веществ, на которые реагирует электрод) 102.Потенциометрический метод анализа. Обнаружение конечной точки титрования с использованием кривой титрования, её производных и метод Грана.
|
||||
|
Последнее изменение этой страницы: 2016-06-29; просмотров: 271; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.216.174.32 (0.013 с.) |




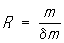 - разрешающая способность масс-спектрометра.
- разрешающая способность масс-спектрометра.
 численно равна силе тока, проходящего через слой раствора с поперечным сечением, равным единице, под действием градиента потенциала 1В на единицу длины.
численно равна силе тока, проходящего через слой раствора с поперечным сечением, равным единице, под действием градиента потенциала 1В на единицу длины. эквивалентная электропроводность –
эквивалентная электропроводность – 
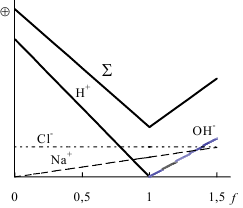 Кривая титрования HCl раствором NaOH
Кривая титрования HCl раствором NaOH Если на рабочем электроде протекает электрохимическая реакция первого порядка, то сила тока с течением времени уменьшается по экспоненциальному закону. Практически при проведении электролиза всегда остается некоторый фоновый ток (Iф), обусловленный превращением примесей, поэтому обычно электролиз считают законченным, когда сила тока станет равной 0,01-0,001 от первоначального значения. Для определения количества электричества, прошедшего через электролитическую ячейку, используют следующие приёмы: с помощью электронного интегратора тока, с помощью химического интегратора тока("кулонометра"), как площадь под кривой "ток-время".
Если на рабочем электроде протекает электрохимическая реакция первого порядка, то сила тока с течением времени уменьшается по экспоненциальному закону. Практически при проведении электролиза всегда остается некоторый фоновый ток (Iф), обусловленный превращением примесей, поэтому обычно электролиз считают законченным, когда сила тока станет равной 0,01-0,001 от первоначального значения. Для определения количества электричества, прошедшего через электролитическую ячейку, используют следующие приёмы: с помощью электронного интегратора тока, с помощью химического интегратора тока("кулонометра"), как площадь под кривой "ток-время".



