
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Влияние различных факторов на растворимость малорастворимых электролитов. Общие принципы растворения осадков малорастворимых электролитов.Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
1) Природа растворяемого в-ва и растворителя. На растворимость влияют такие ф-ры: склонность в-ва к сольватации данным растворителем, способность растворенного в-ва изменять стр-ру р-ля, размер частиц осадка и т.д. Прис. орг. р-ля в водном р-ре обычно уменьшает растворимость малор. Электролитов. 2)температура. В целом у большинства малораств. Электролитов при пов. Температуры растворимость в воде увеличивается, что связано с поступлением доп. Энергии, компенсирующей энергию, необх. Для разрушения кристалл. Решетки. 3)ионная сила. Увел. Ионной силы р-ра приводит к пов. Растворимости(солевой эффект). 4)общий ион. Если к р-ру добавить нек. кол-во хорошо растворимого электролита, сод. тот же ион, что и малорастворимый электролит, то растворимость малораств. электролита уменьшится. 5)побочные р-ции. В рез-те побочных р-ций равновесие в с-ме «осадок-нас. р-р» смещается в сторону протекания процесса растворения, а значит, и при опр. условиях его можно будет практически полностью перевести в р-р. Принципы. Частичное или полное растворение осадка может происх. при след. обстоятельствах: разбавлении р-ра, его нагревании, увел. Ионной силы и др. В юбщем случае условия растворения осадка будут зависеть от величины Кs осадка, а также св-в(Ка, бэта) того соединения, кот. обр. в рез-те его растворения. Количественная оценка окислительно-восстановительной способности веществ. Электродные потенциалы. Стандартный электродный потенциал полуреакции. Уравнение Нернста. Константа равновесия окислительно-восстановительной реакции. Для количественной оценки способности в-в отдавать и принимать электроны исп. электродные потенциалы. Электродный потенциал- разность потенциалов, кот. возникли на границе «металл-р-р» в рез-те разделения зарядов. Стандартный электродный потенциал полур-ции- это ЭДС гальванического элемента, сост. из нах. в станд. условиях электрода, на кот. протекает данная полур-ция, и стандартного водородного электрода. Гальвани́ческий элеме́нт — химический источник электрического тока, основанный на взаимодействии двух металлов и (или) их оксидов в электролите, приводящем к возникновению в замкнутой цепи электрического тока.
Стандартный водородный электрод пр.собой платиновую пластину, насыщенную водородом, кот.нах.в р-ре серной к-ты с а(Н+)=1. Уравнение Нернста: Уравнение Нернста описывает влияние активности компонентов, участв.в процессе, и температуры на величину потенциала. Взаимосвязь между общей концентрацией в-ва в р-ре и активностью его формы:
Константа равновесия окисл.-восст. р-ции:
ОВР широко исп.в титриметрии, для обнаружения неорг. и орг. в-в,для маскировки мешающих ионов, во многих электрохим.и кинетических методах анализа. С ним связаны процессы обмена веществ, протекающие в живом организме, гниение и брожение, фотосинтез. ОВР сопровождают круговорот веществ в природе. Их можно наблюдать при сгорании топлива, в процессах коррозии металлов, при электролизе и выплавке металлов другие ценные продукты. ОВР лежат в основе преобразования энергии взаимодействующих химических веществ в электрическую энергию в гальванических и топливных элементах. Формальный электродный потенциал. Влияние различных факторов(температура, посторонние ионы, рН, побочные реакции) на протекание ОВР. Использование ОВР для маскировки нежелательного влияния ионов. Формальный электродный потенциал E Ox/Red0′ - это потенциал полуреакции, измеренный при условии, что концентрации окисленной и восстановленной формы равны 1 моль/л, а концентрации посторонних ионов известны. Формальный электродный потенциал является аналогом условной концентрационной константы равновесия. Величина формального потенциала зависит от ионной силы раствора, природы и концен- трации посторонних электролитов. По величине форм электрод потенциала можно судить о протекании процессов комплексообразования, выпадения осадков. Он равен выделенной полужирным шрифтом сумме первых трех членов в приведенном выше уравнении.
Температура Температура влияет как на константу равновесия ОВР, так и на их скорость. Как правило, ОВР обладают большим тепловым эффектом, поэтому изменение температуры оказывает значительное влияние на константу равновесия. Многие ОВР идут при комнатной температуре медленно (например, реакция окисления оксалат-ионов перманганат-ионами), и для их проведения требуется нагревание. Иногда, наоборот, нагревание является нежелательным. Посторонние ионы Присутствие посторонних индифферентных ионов в растворе приводит: 1. к повышению ионной силы раствора. Если коэффициенты активности окисленной и восстановленной формы при этом изменяются неодинаково, то изменяется и величина ОВ потенциала. 2. посторонние ионы могут оказывать влияние на скорость реакции. Анионы влияют на реакцию между катионами, катионы - на реакцию между анионами.
Влияние рН Ионы H+ могут: 1. сами участвовать в ОВР 2.окисленная или восстановленная форма может протонироваться, образуя новые ОВ пары.
Образование малорастворимых соединений Приводит к уменьшению концентрации окисленной или восстановленной формы и, сле- довательно, к изменению величины электродного потенциала.
Комплексообразование Окисленная или восстановленная форма либо они обе вместе могут связываться в комплексные соединения с ионами, присутст- вующими в растворе. Это приводит к изменению величины электродного потенциала.
|
||||
|
Последнее изменение этой страницы: 2016-06-29; просмотров: 724; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.191.28.200 (0.008 с.) |

 Схема гальванического элемента Даниэля-Якоби.
Схема гальванического элемента Даниэля-Якоби.
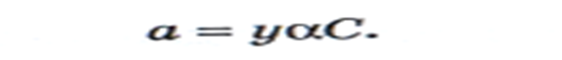
 Взаимосвязь константы равновесия ОВР и ЭДС:
Взаимосвязь константы равновесия ОВР и ЭДС:



