Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Систематический ход анализа катионов IV-vi аналитических групп катионов по кислотно-основной классификацииСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
В анализируемом растворе могут находиться: Al, Zn, Cr3+, Mn2+, Fe3+, Bi3+, Cu2+, Co2+, Ni2+ Раствор не окрашен => нет Fe3+, Cu2+, Co2+, Ni2+, Cr3+. 1. Предварительные реакции с NaOH, NH3, Na2S. Cмотрим на цвет осадка и его растворимость в HNO3, NaOH, NH3. А) полностью раств-ся осадок гидроксида при добавлении изб. NaOH => нет 5 и 6 групп (кроме Cu2+). Б) полное растворение в NH3 – нет 4 и 5групп (кроме Cr3+, Zn2+) В) Темные осадки => может быть были и светлые, светлые – темных точно не было
2. Определяем отдельные катионы Fe3+ с K4[Fe(CN)6], KSCN Cr3+ с H2O2 – образование надхромовых кислот Mn2+ окисление с NaBiO3 Bi3+ с KI, тиомочевиной Для обнаружения 4 группы 1. +NaOH + H2O2, tº, охлаждают 2. Дитизон на цинк, ализарин на алюминий (перед ализарином укс. к-та до начала выпадения гидроксида алюминия, потом ализарин, tº, укс. к-та до кислой реакции) Для обнаружения 6 группы 1. +NH3, смотрим цвет 2. Синий – Cu2+, но м.б. Co2+, Ni2+. Нет синего цвета – нет меди. 3. Диметилглиоксим на никель, KSCN на кобальт. 4. КSCN после нейтрализации р-ра HNO3 +амил. спирт.: если только кобальт – голубой, если еще и медь – зеленый (медь желт. компл., желт+голуб=зел)
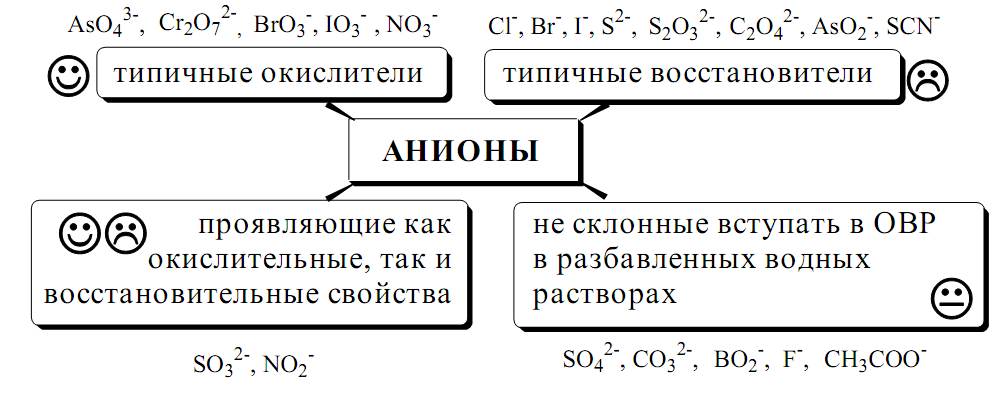
Аналитическая классификация аниоинов, групповые реагенты. Групповые реагенты в классификации ионов по растворимости солей бария и серебра, по окислительно-восстановительным свойствам. Предварительные испытания при анализе анионов. Реакции обнаружения анионов могут быть основаны на их окислительно-восстановительных свойствах, способности образовывать малорастворимые соединения, а также на взаимодействии с кислотами с образованием газообразных продуктов. Классификации анионов не являются строго установленными. Например, в зависимости от растворимости солей бария и серебра анионы разделяют на:
По окислительно-восстановительным свойствам анионы можно разделить на следующие группы:
Обнаружение анионов целесообразно начинать с предварительных испытаний: • установление рН раствора. Если среда кислая (рН<2), в ней не могут присутствовать анионы летучих и неустойчивых кислот (SO32¯, S2O32¯, CO32¯, NO2¯). Кроме того, в кислой среде в растворе не могут одновременно присутствовать анионы-окислители и анионы восстановители. • испытание на выделение газообразных веществ под действием разбавленных кислот. Исследуемый раствор обрабатывают 1 М H2SO4. Выделение СО2 указывает на присутствие СО32¯, SО2 на SО32¯, NО2 на NО2 ¯, одновременно SО2 и осадка S на присутствие S2О32-. Выделение I2 говорит об одновременном присутствии I ¯и анионов-окислителей. • испытание на присутствие анионов I группы. К исследуемому раствору добавляют раствор BaCl2 при рН 7-9. Отсутствие осадка S2О32¯ указывает на отсутствие анионов 1 группы, хотя BO2 образуют осадки с BaCl2 в концентрированных растворах. • испытание на присутствие анионов II группы. К исследуемому раствору добавляют раствор AgNO3 в присутствии разбавленного раствора НNO3. Отсутствие осадка указывает на отсутствие анионов 2 группы. • испытание на присутствие анионов-окислителей. К исследуемому раствору добавляют раствор KI в присутствии разбавленной H2SO4. Если при этом не выделяется I2, то анионы-окислители отсутствуют. • испытание на присутствие анионов-восстановителей. К исследуемому раствору добавляют раствор KMnO4 в нейтральной среде и нагревают. Выпадение темно-бурого осадка указывает на присутствие анионов-восстановителей. Дополнительно можно проверить наличие сильных восстановителей по обесцвечиванию раствора I2. Далее проводят реакции обнаружения анионов, отсутствие которых не было доказано в предварительных испытаниях. Раствор, в котором проводят обнаружение, не должен содержать никаких катионов кроме K ⁺, Na ⁺,NH4 ⁺. Мешающие катионы удаляют путем кипячения с раствором Na2CO3 (готовят «содовую вытяжку»). Анализ неизвестного неорганического вещества. Предварительные испытания. Переведение анализируемого вещества в раствор. Проведение анализа. Анализ неизвестного вещества можно условно разделить на 3 этапа: I. Предварительные испытания II. Переведение анализируемого вещества в растворимое состояние III. Обнаружение катионов и анионов Твердый образец измельчают и делят на 4 части: первая часть используется для предварительных испытаний, вторая – для обнаружения катионов, третья – для обнаружения анионов, четвертая – для повторного исследования. Предварительные испытания - органолептическое исследование (определение цвета, запаха, формы кристаллов, реакция среды с помощью индикатора, летучесть) - окрашивание пламени горелки (на очищенную, промытую и тщательно высушенную нихромовую или платиновую проволоку помещают пробу и вносят в пламя, разные металлы окрашивают пламя в различные цвета: натрий-желтый, калий-фиолетовый, медь-зеленый и т.д.) - действие кислот (при действии на пробу разб.минеральных кислот могут выделяться различные газы СО2,SO2,H2S,NO2) - растворение пробы в воде и определение рН раствора (если проба полностью растворяется в воде, то после определения рН можно сделать выводы о составе образца: в кислом растворе не могут содержаться соли неустойчивых кислот, в щелочном – соли слабых оснований, кроме того по окраске полученного раствора можно судить о наличии в образце окрашенных ионов(например, кобальта, никеля, меди, хрома))
|
||||
|
Последнее изменение этой страницы: 2016-06-29; просмотров: 467; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.191.223.30 (0.006 с.) |