Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Понятие о кривой титрования, степень оттитрованности, кривые титрования в ациди- и алкалиметрии, факторы, влияющие на величину скачка к-о титрованияСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
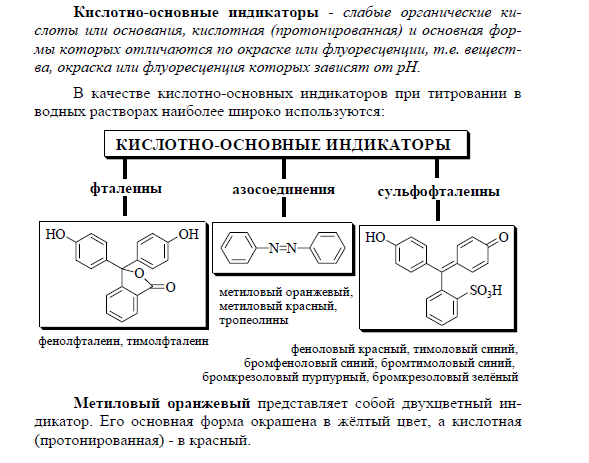
Кривая титрования –график зависимости параметра системы,связанный с концентрацией титруемого веществва, титранта или продукта реакции, от степени протекания процесса титрования. Степень оттитрованности - отношение уже добавленного объема р-ра титранта к тому его объему, который необходимо добавить для достижения точки эквивалентности. Кривая титрования сильной кислоты сильной щелочью характеризуется следующими особенностями. 1 Исходная точка титрования лежит в сильнокислой среде, 2 Точка эквивалентности лежит на линии нейтральности. 3 В начале титрования рН изменяется очень медленно. Резкое изменение начинается только при приливании последней 0,1 части рабочего раствора. 4 Скачок титрования (при титровании 0,1 н. раствора кислоты) очень велик — от рН = 4 до рН = 10. Расчет точек кривой титрования можно свести в таблицу. Если бы титрование шло в обратном порядке, т. е. в титровальной колбе находилась бы щелочь, а в бюретке кислота, то кривая титрования сохранила бы тот же вид, но исходная точка титрования находилась бы в нижней части графика при OН = 13. На величину скачка титрования влияют следующие факторы: концентрация титруемого в-ва и титранта, сила титруемой к-ты или осн, температура, ионная сила р-ра. При уменьшении конц титруемого в-ва и титранта величина скачка титрования ум. При уменьш. силы титруемой к-ты или осн величина скачка титрования ум. Температура и ионная сила влияют на автопротолиз. (при повышении температуры константа автопротолиза ув-ся, величина скачка ум-ся). Аналогичным образом действуем ионная сила. 50.Основные понятия, связанные с титриметрическими методами анализа: титрование, титрант, точка эквивалентности, конечная точка титрования, индикатор, кривая титрования, степень оттитрованности. Требования, предъявляемые к реакциям в титриметрии. Титрование -это процесс определения вещества,при котором к нему постепенно добавляют небольшие порции реагента до того момента, пока все определяемое вещество не вступит в реакцию. Титрант - реагент, используемый при титриметрических определениях . Точка эквивалентности - момент титрования, при котором количество добавляемого титранта становится химически эквивалентным количеству определяемого вещества. Конечная точка титрования -момент титрования, в который изменение свойства указывает на достижение эквивалентности . Индикатор - вещество, видимо изменяющее свои свойства при изменении концентрации какого-либо компонента в растворе. Кривая титрования –график зависимости параметра системы, связанный с концентрацией титранта (титруемого в-ва, продукта р-ции), от степени протекания процесса титрования. Степень оттитрованности - показывает долю вещества, которая была оттитрована стандартным раствором в ходе титрования. Она меняется от 0 до 1 в точке эквивалентности. требования: вещества должны реагировать в строго количественных (стехиометрических) отношениях без побочных реакций, реакции должны протекать быстро и практически до конца; для установления точки эквивалентности необходимо применять достаточно надежные способы, влияние посторонних веществ на ход реакции должно быть исключено. Кроме того, желательно, чтобы при титриметрическом анализе реакции протекали при комнатной температуре. 51. Титранты и стандартные вещества в титриметрических методах анализа. Первичные и вторичные стандартные вещества, Требования, предъявляемые к стандартным веществам. • состав строго соответствует химической формуле; • выпускаются промышленностью в чистом виде (квалификация не ниже «ч.д.а.») либо легко подвергаются очистке; • устойчивы при обычных условиях; • нелетучи и, по возможности, не содержат кристаллизационной воды (можно использовать и кристаллогидраты, если они устойчивы). • имеют большую молярную массу (меньше погрешность при измерении массы). 52. Кислотно-основные индикаторы. Интервал перехода окраски кислотно-основных индикаторов. Примеры кислотно-основных индикаторов. Виды индикаторных погрешностей. Индикаторами называются вещества, изменяющие свою окраску в зависимости от pH среды.Если индикатор выбран правильно, то изменение окраски должно происходить в точке эквивалентности или вблизи нее. В зависимости от характера процесса, индикаторы бывают: кислотно-основные, окисл.-восстанов., металлоиндикаторами, осадительными и адсорбционными. 53.Принцип кислотно-основного титрования. Ацидиметрия и алкалиметрия. Приготовление и стандартизация растворов титрантов кислотно-основного титрования. Кислотно-основной метод анализа основан на реакции, при которой происходит связывание катионов H+ с OH- (ионами гидроксида). Образуются молекулы воды (H2O) и, следовательно, при титровании происходит изменение pH раствора. Этим методом определяют содержание солей слабых кислот и сильных гидроксидов (Na2CO3), солей сильных кислот и слабых гидроксидов ((NH4)2SO4), основных и кислых солей (Ca(HCO3)2), Fe(OHCl)2), оксидов (Na2O), жесткости. Основным стандартным раствором в этом методе является раствор кислоты и раствор щелочи KOH, NaOH. Кислотно-основные методы делят на 2 вида анализа: Алкалиметрию ацидиметрию Алкалиметрия - в данном анализе стандартным раствором является раствор щелочи: KOH, NaOH. Его готовят в приближенной концентрации, а точную концентрацию устанавливают по щавелевой кислоте или раствору KOH известной концентрации. Этим методом определяют содержание кислот, солей слабо гидролизующихся и сильных кислот. Ацидиметрия - стандартным раствором является раствор кислоты, который готовят в приближенной концентрации, а точную концентрацию устанавливают по химически чистым веществам Na2B4O7·10H2O, или Na2CO3. Данным методом определяют в исследуемых растворах содержание щелочей, солей, сильно гидролизуемых и слабых кислот (подвергающихся гидролизу, имеющих щелочную среду), оксидов (CaO, BaO, MgO), а также карбонатную жесткость воды. По ходу кислотно-основного титрования изменяется концентрация H+ и OH-, следовательно изменяется и pH титруемого раствора. При определенных значениях pH достигается точка эквивалетности и титрование в этот момент заканчивается. Стандартизацию растворов титрантов можно проводить также с помощью вторичных стандартных веществ. Cтандартные растворы можно готовить из фиксаналов. Стандартные растворы HCl и H2SO4 устойчивы при хранении. Их хранят при обычных условиях в закрытой посуде. Растворы щелочей поглощают CO2 из воздуха, поэтому их следует хранить в плотно укупоренной таре. Для предотвращения взаимодействия щёлочи и CO2 растворы защищают с помощью трубки, заполненной оксидом кальция или натронной известью. Исходный образец щёлочи, например, NaOH может содержать некоторое количество карбоната в качестве примеси. Для того чтобы получить раствор, свободный от этой примеси, поступают следующим образом: в свежепрокипячённой воде растворяют определённую навеску NaOH, так чтобы получился концентрированный раствор этого вещества. Полученный раствор оставляют на некоторое время в плотно укупоренной посуде. Карбонат натрия плохо растворим в концентрированном растворе NaOH и выпадает в виде осадка. Через некоторое время прозрачный раствор сливают с осадка и разбавляют до необходимой концентрации свежепрокипячённой водой. Растворы щелочей, особенно концентрированные, не рекомендуется хранить в стеклянной посуде. 54.Титрование многоосновных кислот и многокислотных оснований. Анализ смеси гидроксида и карбоната щелочного металла, смеси карбоната и гидрокарбоната. Титрование многоосновных кислот или многокислотных оснований имеет несколько точек эквивалентности, и соответственно кривая рН дает несколько перегибов, в большинстве случаев, однако, не резко выраженных. Типичны следующие варианты титрования: 1) титрование сильной кислоты сильным основанием; 2) титрование сильного основания сильной кислотой; 3) титрование слабой кислоты сильным основанием; 4) титрование слабого основания сильной кислотой; 5) титрование многоосновных кислот или многокислотных оснований; 6) титрование смесей кислот или смесей оснований разной силы. Анализ смеси гидроксида и карбоната щелочного металла, смеси карбоната и гидрокарбоната: Кривая титрования карбоната щелочного металла раствором сильной кислоты имеет 2 скачка титрования: первый соответствует реакции превращения карбоната в гидрокарбонат, а второй - реакции превращения гидрокарбоната в угольную кислоту. Конечную точку титрования СО32- до НСО3- можно обнаружить с помощью фенолфталеина, а конечную точку титрования Н2СО3 – с помощью метилового оранжевого. 55.Способы титриметрического определения солей аммония, Определение азота в органических соединениях методом Кьельдаля, Определение борной кислоты
Определение азота в органических соединениях методом Кьельдаля: Точную навеску анализируемого вещества помещают в колбу Кьельдаля и подвергают минерализации с помощью концентрированной серной кислоты, к которой добавляют K2SO4 и CuSO4 (катализатор). В процессе минерализации азот превращается в ион аммония. После окончания процесса к раствору добавляют NaOH. При этом образуется NH3, который затем отгоняют и поглощают раствором борной кислоты или стандартным раствором сильной кислоты (H2SO4 или HCl). В первом случае при взаимодействии борной кислоты с аммиаком образуется эквивалентное NH3 количество иона [B(OH)4]-, который затем титруют стандартным раствором HCl (титрование заместителя). Во втором случае определяют избыток сильной кислоты, не вступивший в реакцию с NH3, титруя раствор стандартным раствором NaOH (обратное титрование). Определение борной кислоты: Наиболее часто применяемым на практике комплексообразователем при определении борной кислоты является глицерин. Глицерин, используемый в лаборатории, может также содержать примеси кислот, поэтому перед применением его необходимо нейтрализовать раствором щелочи до появления слабо-розового окрашивания фенолфталеина. 56. Титрование в неводных средах. Критерии выбора растворителя для кислотно-основного титрования. Константа титрования. Практическое применение кислотно-основного неводного титрования в фармацевтическом анализе для определения слабых кислот и оснований. Титрование в неводных средах – титрование, при котором средой служит неводный растворитель Критерии выбора растворителя для кислотно-основного титрования: 1)Растворитель, используемый для определения веществ основного характера, должен обладать кислотными свойствами. И наоборот. 2)Желательно, чтобы константа автопротолиза растворителя была невелика.3)Диэлектрическая проницаемость растворителя, по возможности, должна быть большой. 4)Растворитель должен растворять определяемое вещество по крайней мере в такой степени, чтобы можно было получить 0,01М раствор 5)Растворитель не должен вступать в побочные химические реакции с определяемым веществом 6)При титровании в среде данного растворителя должно быть возможным обнаружение конечной точки титрования 7)Растворитель должен быть, по возможности, не слишком токсичным, а также легко подвергаться очистке от примесей, абсолютированию и др. Выбор растворителя осуществляется на основании величин констант титрования КТ. Чем меньше эта величина КТ (т.е. чем больше рКТ), тем лучше условия и точность титрования. Константа титрования - отношение ионного произведения растворителя KSH к константе ионизации кислоты Ка или основания Кb: КТ = KSH / Ка (для кислоты) КТ = KSH / Кb (для основания) Практическое применение кислотно-основного неводного титрования в фармацевтическом анализе для определения слабых кислот и оснований: Для неводного титрования в фарм.анализе применяют все группы растворителей: кислотные, основные, амфотерные и инертные. Кислотные растворители: уксусная кислота, уксусный ангидрид. Указанные растворители используют при определении различных слабых оснований, которые могут быть незаряженными (кофеин) или заряженными (анионы). Из группы основных растворителей в фарм.анализе используют диметилформамид (растворитель при определении различных ЛС кислотного характера (барбитуратов, сульфаниламидов и др.)) Растворители, титранты, стандартные вещества и индикаторы: Наиболее важной физической константой, используемой для классификации растворителей, является диэлектрическая проницаемость ε, поскольку именно с этой величиной связана диссоциирующая способность среды. Существует несколько классификаций растворителей по их химическим свойствам: по классам химических соединений (или по функциональным группам); кислотно-основным свойствам; специфическому взаимодействию с растворенным веществом. Индикация конечной точки титрования: Конечную точку титрования в неводных растворителях фиксируют с использованием кислотно-основных индикаторов или при помощи инструментальных методов. Для определения кислот используют индикаторы: азофиолетовый, тимолфталеин, тимоловый синий, нейтральный красный. Для определения оснований применяют кристаллический фиолетовый, диметиловый желтый и др. Однако конечную точку титрования наиболее точно определяют электрометрическими методами анализа - потенциометрическим или кондуктометрическим. 57.Общая характеристика и классификация методов комплексонометрического титрования. Общая характеристика комплексонометрического титрования. Характеристика свойств этилендиаминтетрауксусной кислоты и ее взаимодействие с катионами металлов. Равновесия в водных растворах ЭДТА. Состав и устойчивость комплексонатов металлов. Факторы, влияющие на величину скачка титрования. Комплексонометрическое титрование – титриметрический метод анализа, основанный на образовании хелатов при взаимодействии катионов металлов с комплексонами. Комплексоны – органические соединения, в молекулах которых содержится большое число основных донорных центров и кислотных функциональных групп, расположенных так, что при их взаимодействии с катионами металлов образуются высокоустойчивые внутрикомплексные соединения, содержащие не менее двух циклов. Требования, предъявляемые к реакциям, применяемым в комплексонометрическом титровании: большая константа равновесия, стехиометричность, протекание с приемлемой скоростью при обычных условиях, возможность обнаружения конечной точки титрования. Этилендианимтетрауксуснаякислота (ЭДТА или Na2H2Y) – белое кристаллическое негигроскопичное вещество, малорастворимое в воде и этаноле. ЭДТА(Н4Y) является четырехосновной кислотой, а если рассматривать в качестве исходной протонированную структуру Н6Y2+, то шестиосновной. Нейтральная форма ЭДТА имеет цвиттер-ионную структуру ЭДТА образует комплексы с катионами практически всех металлов. ЭДТА является гексадентантным лигандом и в большинстве случаев взаимодействует с катионами металлов в соотношении 1:1. В комплексах ЭДТА часть связей носит ионный характер, часть – донорно-акцепторный. Комплексы многих металлов с ЭДТА образуются легко, обладают достаточной устойчивостью и в большинстве случаев растворимы в воде. Все это позволяет использовать ЭДТА для титриметрического определения солей металлов. Устойчивость комплексов металлов с ЭДТА различна, зависит от природы ионов металла, его зарядности (чем больше заряд иона металла, тем устойчивее комплекс), электронной конфигурации и меняется в зависимости от рН среды. Наиболее устойчивые комплексы с многозарядными ионами могут образовываться и в кислой среде. К ним относятся комплексы с Bi3+; Fe3+; Cr3+ и т. д. Менее устойчивые комплексы с ЭДТА образуют Ba2+; Mg2+; Ca2+ и т. д. Их определение комплексонометрическим титрованием проводят в щелочной среде. Величина скачка титрования зависит: 1)от прочности образующегося комплексоната - чем больше константа устойчивости, то есть чем прочнее комплексонат, тем больше скачок; 2)от кислотности среды – чем она выше, то есть чем меньше значение рН, тем меньше скачок; 3)от концентрации реагирующих веществ – чем больше концентрация титранта и определяемого иона, тем больше скачок; 4)от присутствия дополнительных комплексообразователей – чем их больше, тем меньше скачок. 58.Металлоиндикаторы. Общая характеристика, классификация, взаимодействие с ионами металлов, интервал перехода окраски металлохромных индикаторов. Примеры металлохромных индикаторов применение в фармацевтическом анализе. Металлоиндикаторы – вещества, изменяющие окраску (или флуоресценцию) в зависимости от концентрации катионов металла в растворе. Металлоиндикаторы можно разделить на 2 основные группы: 1) органические и неорганические соединения, которые не имеют собственной окраски, но при взаимодействии с катионами металлов образуют окрашенные комплексы; 2) интенсивно окрашенные органические вещества, образующие с катионами металлов внутрикомплексные соединения, окраска которых отличается от окраски свободного индикатора (металлохромные индикаторы), некоторые металлоиндикаторы 2-ой группы образуют с катионами металлов флуоресцирующие внутрикомплексные соединения (металлофлуоресцентные индикаторы). Металлохромные индикаторы: Эриохром черный Т(хромоген черный ЕТ 00) – образует комплексы винно-красной или фиолетовой окраски (использ. в слабощелочн.растворах рН=8-10) Пирокатехиновый фиолетовый – с металлами образует комплексы синего цвета (используется при различных значениях рН). Ксиленовый оранжевый –образует комплексы желтого и красного цвета (используется при различных значениях рН). Мурексид – неионизированная форма окрашена в желтый цвет, моноанион – красно-фиолетовый, дианион – фиолетовый, а трианион – голубой (используется при различных значениях рН) В качестве т итранта в комплексонометрическом титровании используют динатриевую соль этилендиаминоуксусной кислоты, называемую натрия эдетатом (Na2H2Y*2H2O). В титриметрии, по крайней мере в фармацевтическом анализе, используют 0,05М раствор этого вещества. В фармации комплексонометрическое титрование используют для количественного определения препаратов кальция (хлорид, глюконат, лактат и др.), цинка (оксид и сульфат, цинк-инсулин), железа (глицерофосфат, лактат, сахарат, аскорбинат, сульфат и др.), кобальта (цианкобламин, коамид, ферковен), препаратов, содержащих соли магния, висмута, ртути, свинца и других Свойства этилендиаминтетрауксусной кислоты и ее взаимодействие с катионами металлов. 59.Кривые титрования в осадительном титровании.Факторы, влиющие на величину скачка осадительного титрования. Систематические индикаторные погрешности осаительного титрования.
60.Общая характеристика и классификация методов осадительного титрования. Требования, предъявляемые к реакциям. Меркурометрическое титрование. Принцип метода. Условия проведения титрования. Титранты. Обнаружение конечной точки титрования. Практическое применение меркуриметрического титрования. Осадительным титрованием называют группу титриметрических методов анализа, основанных на реакциях образования малорастворимых соединений, выделяющихся из раствора в виде осадка. Для того, чтобы реакция могла быть использована в осадительном титровании, она должна протекать количественно (величина Кs образующегося осадка для бинарных электролитов не должна превышать 10-8 – 10-10) и быстро при обычных условиях, не сопровождаясь при этом образованием пересыщенных растворов. Образующийся осадок должен иметь постоянный состав и не загрязняться в процессе осаждения. Наконец, должна существовать возможность визуально или инструментально обнаружить конечную точку титрования. Аргентометрическим титрованием называется титриметрический метод анализа, основанный на образовании малорастворимых соединений серебра. Основной титрант- AgNO3. Аргентометрия используется для определения галогенидов, тиоцианатов, цианидов, фосфатов и других ионов. Меркурометрическим титрованием называется тетриметрический метод анализа, основанный на образовании малорастворимых соединений ртути (I). Меркурометрия используется для опредеделения хлорид- и бромид –ионов. Титрантом метода является 0,1М раствор Hg2(NO3)2. Готовят как вторичный стандартный раствор, так как соли ртути (I) неустойчивые, гигроскопичны. Точно рассчитанную навеску Hg2(NO3)2 добавляют в мерный цилиндр, прибавляют несколько капели ртути и азотной кислоты; переливают в посуду для хранения и остаивают в течение суток. Стандартизуют по растворам KCl, NaCl. Конечную точку титрования определяют с помощью индикаторов дифенилкарбазона (синяя окраска) и Fe(SCN)3 (по исчезанию красной окраски). Титрование проводят в кислой среде при интенсивном перемешивании. Широкое распространение в практике фармацевтического анализа меркурометричское титрование не имеет (в отличие от меркурометрического). Его важной особенностью является возможность определения галогенид-ионов в сильнокислых растворах. 61.Аргентометрическое титрование. Кривая аргентометрического титрования. Факторы, влияющие на величину скачка титрования. Обнаружение конечной точки аргентометрического титрования: методы Мора, Фольгарда и Фаянса. Титранты аргентометрического титрования. Практическое применение аргентометрического титрования в фармацевтическом анализе. Аргентометрическим титрованием называется титриметрический метод анализа, основанный на образовании малорастворимых соединений серебра. Основной титрант- AgNO3. Аргентометрия используется для определения галогенидов, тиоцианатов, цианидов, фосфатов и других ионов.
Применяют следующие методы аргентометрического титрования, отличающиеся друг от друга типом индикаторов: метод Мора – индикатор хромат калия; метод Фольгарда – железо-аммонийные квасцы, метод Фаянса – индикаторы флуоресцеин и эозин. Титрантом в методах аргентометрии служит 0,1 н раствор AgNO3. Титр раствора AgNO3 устанавливают по навеске стандарта NaCl или KCl, перекристаллизованного и высушенного до постоянной массы. Для определения Ag+ - ионов используют в качестве титранта 0,1 н раствор NaCl (или KCl), который готовят из точной навески хлорида калия (или хлорида натрия). Метод Мора применим только для определения хлоридов и бромидов в нейтральных и слабощелочных растворах и неприемлем для определения иодидов и роданидов, титрование которых сопровождается образованием коллоидных систем и адсорбцией, затрудняющих установление конечной точки титрования. При титровании хлоридов и бромидов стандартным раствором AgNO3 образуется белый осадок AgCl и желтоватый осадок AgBr. Индикатор K2CrO4 образует с раствором AgNO3 осадок кирпично-красного цвета. Методом Фаянса определяют иодиды, которые невозможно проанализировать методом Мора, а также хлориды и бромиды в присутствии адсорбционных индикаторов – флуоресцеина и эозина. При определении хлоридов в качестве индикатора применяют 0,5 % -й раствор флуоресцеина. Анализируемый раствор с индикатором зеленого цвета титруют раствором AgNO3 до окрашивания осадка в розово-красный цвет. При титровании с флуоресцеином требуется нейтральная или слабощелочная среда. Определение бромидов и иодидов проводят с 0,5 % раствором натриевой соли эозина, меняющей свою розовую окраску на красно-фиолетовую. Метод Фольгарда основан на титровании раствора, содержащего ионы серебра, стандартными растворами NH4NCS или KNCS. Индикатором в этом методе являются ионы Fe3+. После осаждения ионов серебра в виде белого осадка AgNCS избыточная капля титранта реагирует с индикатором - раствором железоаммонийных квасцов NH4[Fe(SO4)2] ∙12Н2О с образованием растворимого красного комплекса. В фармацевтическом анализе аргентометрию применяют для количественного определения органических веществ, образующих малорастворимые серебряные соли (барбитураты, сульфаниламиды, теофиллин и некоторые другие ЛС). 62. Окислительно-восстановительные индикаторы, интервал перехода индикаторов. Примеры окислительно-восстановительных индикаторов. Систематические индикаторные погрешности. Ферроин - двухцветный индикатор, но интенсивность окраски у различных его форм неодинакова. Восстановленная форма имеет интенсивную красно-оранжевую окраску, окисленная – бледно-голубую. В отличие от дифениламина его окислительно-восстановительные свойства в значительно меньшей степени зависят от рН. Изменение окраски О.-В. Принцип оценки величины погрешности при окислительно-восстановительном титровании заключается в сравнении потенциалов в точке эквивалентности и в конечной точке титрования и дальнейшем определении величины f для конечной точки титрования.. 63.Требования, предъявляемые к реакциям окислительно-восстановительного титрования. Кривая окислительно-восстановительного титрования. Факторы, влияющие на величину скачка титрования. Способы обнаружения конечной точки окислительно-восстановительного титрования. Окислительно-восстановительным титрованием называют группу титрим. Методов анализа, основанных на использовании окисл-восстан. Реакций. Те методы, в которых титрантами явл. Окислители наз. Оксидиметрическими (чаще исп. В фарманализе), а те, в кот. Восстановители- редуктометрические. Вещ-ва, использ. В качестве титрантов должны быть достаточно сильными окислителями или восстановителями, а величина ЭДС соответсвующей реакции. Три типа окисл-восстанов. Процессов: 1) процессы, при кот. Кислотность среды не меняется, 2) процессы, при кот кисл. Среды увеличивается, 3) уменьшается. Определяемое вещество при проведении титрования нужно довести до опред. Степени окисления, что бы оно реагировало с применяемым титрантом. Кривые титрования. Кривая титрования – это график зависимости электродного потенциала в случае окисл.-восстан. Титрования (ось ординат) от объема добавленного титранта (ось абсцисс). В процессе титрования после добавления очередной порции титранта в системе будет устанавливаться хим. Равновесие. Величину электродного потенциала для любой точкикривой титрования можно расчитать по уравнению 15.1, 15.2. Величина скачака титрования зависит от разности стандартных потенциалов окислителя и восстановителя. Все факторы влияющие на величину этих потенциалов влияют на величину скачка титрования (температура, присутсвие посторонних ионов, не взаимодействующих с реагирующими веществами, рН, протекание образования комплексных и малорастворимых соединений). Конечную точку титрования обнаруживают визуально либо с помощью различных инструментальных методов, например потенциометрически. Визуально- по изменению окраски непосредственно одногоиз участников протекающей хим. Реакции либо с помощью индикаторов.индикаторы могут быть специфическими (реагируют на изменение конц. Одного из участников хим. Реакции) или окислительно-восстановительнами. О.-В 64.Иодометрическое титрование. Принцип метода. Условия проведения титрования. Титранты. Обнаружение конечной точки титрования. Практическое применение иодометрического титрования. Определение воды методом Карла Фишера. Определение активного хлора. Иод. Титрованием называется титриметрический метод анализа, основанный на определении количества иода, затраченного для полного протекания реакции с в-вом, обладающим восстанов. Св-вами, либо выделившегося в результате реакции KI с веществом, облад. Окислительными свойствами. В качестве титрантов исспользуются иод (трииодид) и тиосульфат натрия. Условия иодометрического титрования ограничиваются тем, что в кислой среде неустойчив тиосульфат, а в щелочной (рН > 8,5) протекают реакции диспропорционирования иода. Прямое иод. Титрование(аскорбиновая к-та, анальгин и др.), Обратное(альдегидов, тиоэфиров,пенициллин, кофеин и др.). Определение воды методом Карла Фишера. Реакция взаимодействия иода с SO2 протекает только в присутствии воды а потому может быть использована для ее определения. Реакция включает 2 стадии: оксид серы 4 взаим. С метанолом с обр. сложного эфира,кот нейтрал. Основанием. Затем соль метилгидросульфата окисляется иодом до соли метилгидрослуфата в присутсвии воды. Активным хлором называется такой хлор, который выделяется в свободном виде при взаимодейтсвии в-ва с хлороводородной к-той. 65.Иодатометрическое титрование. Принцип метода. Условия проведения титрования. Титранты. Обнаружение конечной точки титрования. Практическое применение иодатометрического титрования.
Способ титрования, при котором в качестве титранта используется KIO3. Первичное стандартное вещество – сам KIO3 Условия проведения: в кислой среде иодат восстанавливается до иодида, в 3-9 HCl до монохлорида иода. Обнаружение конечной точки титрования: в умеренно кислой среде, то точку эквивалентности можно обнаружить с помощью крахмала(выделяется иод). Если титрование основанно на восстановлении иодита до монохлорида иода, то проводитсся в очень кислой среде. после каждого добавления титранта добавляют хлороформ или другой неполярный растворитель и встряхивают. Когда все определ. Ве-во вступит в реакцию с иодатом и в раствор появится избыток титранта иод2 окислится до иод-хлор, а слой хлороформа обесцветится(так он был фиолетовый). Используется для определения аскорбиновой к-ты., гидразина и его производных. 66.Нитритометрическое титрование. Принцип метода. Условия проведения титрования. Титранты. Обнаружение конечной точки титрования. Практическое применение нитритометрического титрования. Нит. Титрование представляет собой метод анализа, основанный на применении в качестве титранта NaNo2. В фарм. Анализе используется для определения первичных аромат. Аминов, втор. Аромат. Аминов, а также гидразидов. в основе опред. разделения перв. Аромат. Аминов лежит реакция диазотирования, втор. Аминов –реакция обр. N-нитрозопроизводных, гидразидов-реакция обр. азидов. Станд. Раствор NaNo2 является вторичным. Конечную точку определяют электрохим методами (потенциометрически) или визуально. В качестве внутренних индикаторов исп. Тропеолин 00. В кон. Т. Титр. Окраска тропеолина 00 из красной переходит в бледно-желтую или вообще исчезает. Внешними индикатором служит полоска фильтр бумаги, пропитанная раствором калий иод и затем высушенная. капля раствора должна вызывать немедленное синее окрашивание. 67.Броматометрическое титрование. Принцип метода. Условия проведения титрования. Титранты. Обнаружение конечной точки титрования. Практическое применение броматометрического титрования. Бромат. Титр. Называется метод анализа, основанный на применении в качестве титранта KbrO3. 1) Определения, основанные на окислении определяемого вещества броматом в кислой среде; бромат-ион при этом восстанавливается до бромида. 2) Определения, основанные на взаимодействии определяемого вещества с бромом, получаемым в процессе реакции KbrO3 с Kbr в кислой среде.(бромометрическое титрование) Кон. Точку титрования при титр раствором калий бром О3 обнаруживают по появлению в растворе свободного брома(желтый окрас).Индикаторы: метиленовый красный, метиловый оранжевый.Также КТТ можно обнаружить потенциометрически или фотометрически. Прямое броматометр. Титровани используется для определения аскор. К-ты, гадразина, щавелевой к-ты и др.
При бромометрическом титровании титрантом является бром. Бромометрич титрование ведут в присутсвии избытка калий брома, кот добавляют в р-р опред вещества или титранта.Прямым титрованием определяют тимол,стрептоцид, хинин и др. 68.Дихроматометрическое титрование. Принцип метода. Условия проведения титрования. Титранты. Обнаружение конечной точки титрования. Практическое применение дихроматометрического титрования. Дихроматометрическое титрование - титриметрический метод анализа, основанный на применении в ка
|
||||
|
Последнее изменение этой страницы: 2016-06-29; просмотров: 931; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.147.56.125 (0.013 с.) |