
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Кривые титрования. Выбор индикатора.Содержание книги
Поиск на нашем сайте
Для того чтобы наиболее точно зафиксировать точку эквивалентности титрования, необходимо выбрать такой индикатор, который резко меняет свою окраску при значении рН, максимально близком к эквивалентной точке. Изменение рН при нейтрализации различных по степени диссоциации кислот и оснований обычно изображают графически. Такие графики постепенного изменения рН при кислотно-основном титровании называют кривыми нейтрализации, или кривыми титрования кислотно–основного метода. По таким кривым можно выбрать нужный индикатор. В качестве титрантов в кислотно–основном методе обычно применяют сильные кислоты или сильные основания, поэтому здесь возможны следующие 3 случая:
1) титрование сильной кислоты сильным основанием (и наоборот), 2) титрование слабой кислоты сильным основанием, 3) титрование слабого основания слабой кислотой.
Рассмотрим ход кривой титрования более подробно на примере (1), при нейтрализация сильной кислоты сильным основанием. Предположим, что мы титруем раствор HCl 0.1 н концентрации раствором NaOН той же концентрации. Сильные основания и сильные кислоты практически полностью диссоциированны на ионы, поэтому концентрацию ионов [Н+] можно принять численно равной общей концентрации кислоты. Таким образом, до начала реакции нейтрализации раствор HCl будет иметь концентрацию ионов[H+] = 10-1 г-ион/л, а рН=1. После нейтрализации 90% кислоты, ее осталось 10% от первоначального количества. Следовательно, количество кислоты уменьшилось в 10 раз. Для упрощения вычисления мы пренебрегаем увеличением общего объема раствора. При уменьшении общей концентрации кислоты в 10 раз, во столько же раз уменьшится концентрация ионов водорода, т.е. [H+] = 10-2, а рН= 2. После нейтрализации 99% кислоты общая ее концентрация уменьшилась в 100 раз по сравнению с первоначальной концентрацией. Следовательно, концентрация ионов водорода [H+] = 0,001 = 10-3, в этом случае рН=3. После нейтрализации 99,9% кислоты [H +] = 0,0001 = 10-4, рН = 4. Когда же будет нейтрализована вся кислота (100%), в растворе будет содержаться только соль NaCl, не подвергающаяся гидролизу. Концентрация [Н+] и [ОН-] при этом одинаковы, а рН = 7 и точка эквивалентности совпадает с точкой нейтральности (табл. 2). Если и далее приливать щелочь к титруемому раствору, концентрация ионов [ОН -] будет увеличиваться в том же порядке, как шло уменьшение ионов Н + . При добавлении 1% избытка щелочи концентрация ионов будет [OH -] = 10 -3,а [Н +] = 10-11, значит рН =11. При добавлении 10% избытка NaOH концентрация ионов [OH -] = 10 - 2 , в этом случае [H +] = 10 -12 и рН = 12. Если добавить 100% избытка щелочи, то концентрация ионов гидроксила в растворе будет равна 10 -1, [H+] = 10-13, а рН = 13. Таким образом, при нейтрализации 99,9% кислоты рН изменяется всего на три единицы от 1.0 до 4.0, а переход от 0.1% избытка кислоты к 0.1% избытку щелочи изменяет рН раствора от 4.0 до 10,0. В конце титрования 1-2 капли щелочи снижают концентрацию [Н+] в растворе от 10-4 до 10-10,т.е. - в миллион раз. Такое резкое изменение величины рН вблизи эквивалентной точки, т.е. в конце титрования называется скачкомтитрования, при этом резко меняется окраска индикатора. Это говорит о том, что при выборе индикатора нужно руководствоваться не столько величиной рН в точке эквивалентности, сколько интервалом перехода окраски индикатора. В рассмотренном выше случае можно использовать любой кислотно-основной индикатор, интервал перехода окраски которого лежит в пределах значений рН от 4 до 10. В данном интервале для фиксирования точки эквивалентности можно использовать и фенолфталеин и метилоранж (табл.2,3.) Таблица 3.
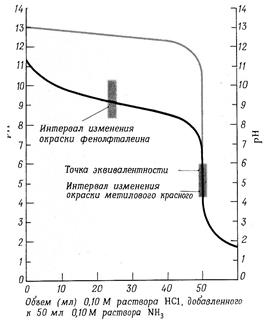
Изменение рН раствора от количества прибавленного раствора сильного основания к сильной кислоте можно выразить графически. На кривой титрования (рис. 4б, светлая линия) четко видно, что рН раствора в процессе титрования изменяется с разной скоростью. В начале титрования при добавлении щелочи от 0 до 99, 9 % рН медленно изменяется всего на 3,3 единицы. При дальнейшем прибавлении щелочи около 100,1% рН резко меняется на 5,6 единицы. Такое резкое изменение рН вблизи точки эквивалентности и есть скачок титрования. Дальнейшее изменение рН происходит медленно. Точка эквивалентности на рисунке совпадает с точкой нейтральности, т.е. находится при рН = 7. Скачок титрования в данном случае не зависит от концентрации сильной кислоты и щелочи.
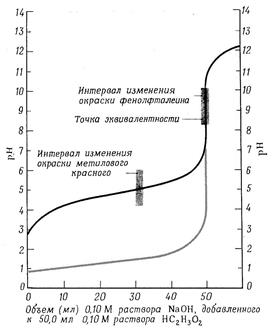
рН рН
а) б) Рис. 4(а) Кривая титрования растворов оснований раствором сильной кислоты. Черная линия (нижняя) представляет собой график изменения рН при титровании 0,10 М раствора аммиака 0,10 М раствором HCl; серая линия показывает часть графика изменения рН при титровании 0,10 М раствора NaOH раствором кислоты. Рис. 4(б) Кривая титрования растворов кислот раствором сильного основания. Черная кривая (верхняя линия) показывает изменение рН при постепенном добавлении 0,10 М раствора NaOH к 0,10 М раствору уксусной кислоты. Серая кривая показывает изменения рН при титровании 0,10 М раствора HCl раствором NaOH. При титровании слабой кислоты сильным основанием расчет значений [H+] и рН, которые будут иметь место на различных стадиях нейтрализации слабой кислоты сильным основанием, производится с учетом концентрации и степени диссоциации слабой кислоты. Кроме того, образующаяся в результате нейтрализации соль, подвергается гидролизу, снижает степень диссоциации слабой кислоты и величина рН раствора зависит также от степени гидролиза соли. Вследствие этого [H+] будет понижаться быстрее. В данном случае точка эквивалентности не совпадает с точкой нейтрализации и титровании заканчивается в щелочной области при рН >7. Скачок титрования сужается и составляет 2.25 единицы. В этом случае из индикаторов можно применять только фенолфталеин (рис. 4 б, темная линия) При титровании слабого основания сильной кислотой вычисления значений рН будут зависеть от концентрации и степени диссоциации слабого основания, а в точке эквивалентности рН будет в основном от степени гидролиза соли, которая будет увеличивать концентрацию ионов [H+]. В результате этого точка эквивалентности находится в кислой области. Скачок титрования составляет 2.25 единицы - от рН, равной 6,25 до 4 (рис.4а) В данном случае можно применять индикаторы: метиловый оранжевый и метиловый красный, имеющие точку перехода окраски приблизительно в тех же пределах. §5. Вопросы и задачи для самостоятельного решения. 1.Титриметрический анализ, его сущность, методы и задачи. Классификация методов титриметрического анализа. 2. Требования к реакциям, применяемых в титриметрических методах анализа. 3.Титранты, их приготовление. Стандартные растворы, фиксаналы. 4.Способы титрования. 5. Расчеты, применяемые в титриметрическом анализе. 6. Сущность и методы кислотно-основного титрования. Реакции, применяемые в кислотно-основном титровании. 7.Точка эквивалентности при кислотно-основном титровании и способы ее определения. 8. Кислотно-основные индикаторы, принцип их действия. Точка и зона перехода индикаторов. 9. Кривые кислотно-основного титрования. Выбор индикатора. 10.Сколько грамм буры (Na2B4O7 ∙ 10 Н2 О) следует взять для приготов- ления 250 мл 0,1 N раствора. Ответ: 4.7675 г. 11.Рассчитайте, какой объем хлороводородной кислоты с плотностью, равной 1,180 г/мл, потребуется для приготовления 200 мл раствора с концентрацией кислоты в 0,05 моль/л. 12.На титрование 5,00 мл раствора серной кислоты израсходовано 4,12 мл 0,1020 М раствора NaOH. Вычислите нормальность и рН раствора кислоты. Ответ: 0,08405 моль/л, рН=1,08
§6. Лабораторный практикум.
Лабораторная работа № 1
Тема:Приготовление исходных рабочих растворов (титрантов). Стандартизация титрантов. Цель работы: Научиться готовить растворы титрантов с определяемым титром и приготовленным титром. Реактивы и оборудование: раствор хлороводородной кислоты 0,1 н концентрации, раствор хлороводородной кислоты (концентрированный), кристаллическая бура (Nа2В4О7 ∙ 10 Н2О) цилиндры на 10, 20 и 200 мл, склянки на 250-300 мл, ареометр. Задание I. Приготовление 200 мл 0,1 н раствора тетрабората натрия.
Для определения титра раствора хлороводородной кислоты используют раствор тетрабората натрия (бура). Эта соль удовлетворяет всем требованиям, предьявляемым к титрантам, т.к. кристаллы и растворы данной соли устойчивы при хранении, состав вещества соответствует формуле. Растворы этих веществ получают при растворении точной навески и называются стандартными или с приготовленным титром. Для приготовления раствора такого типа сначала подсчитывают величину навески вещества с точностью до 0,01г по формуле: m= M( где М Взвешивают рассчитанную навеску на технических весах в бюксе и количественно переносят в мерную колбу через воронку, с которой смывают кристаллы аккуратно в колбу. Бюкс с остатками кристаллов снова взвешивают и определяют более точно навеску. Для растворения соли приливают половину колбы дистиллированной воды, нагревают на водяной бане, перемешивая до полного растворения. Затем охлаждают содержимое колбы до комнатной температуры и доводят до метки сначала небольшими порциями воды, затем по каплям с помощьюпипетки. Закрывают колбу пробкой и перемешивают. Приготовленный раствор переливают в сухую чистую склянку, закрывают пробкой и подписывают. Концентрацию буры рассчитывают по формуле: СN = m / Э ∙ V. Более точную концентрацию определяют по титру по формуле: Т = m / V, где m- навеска вещества, V- объём колбы
Задание 2. Приготовление 200 мл 0,1N раствора хлороводородной кислоты из более концентрированного раствора. Ход работы. 1. Измеряют ареометром плотность исходной концентрированной кислоты, по таблице в справочнике находят ее процентную концентрацию и вычисляют молярную концентрацию эквивалента CN по формуле: СN = w % ∙ r ∙ 10 / Э СN = N (нормальность раствора) Объем исходной кислоты, необходимой для приготовления раствора заданной концентрации, рассчитывают по формуле: V1 ∙ N1 = V2 ∙ N2 V1, N1–объём и концентрация исходной кислоты; V2, N2 – объём и концентрация кислоты после разбавления. 2. Рассчитанный объём кислоты отмеряют мерным цилиндром, переносят в мерную колбу, цилиндр несколько раз ополаскивают водой, сливая эту воду в мерную колбу с кислотой, затем доливают воду до метки, закрывают колбу и перемешивают. Раствор получается с приблизительной концентрацией. Более точную концентрацию приготовленного раствора устанавливают по стандартному раствору тетрабората натрия. Стандартный раствор хлороводородной кислоты можно приготовить также из фиксанала. Фиксанал - это стандарт-титр, приготовленный промышленным путём и представляет собой стеклянную запаянную ампулу с количеством вещества, необходимым для приготовления 1л точно0,1 или 0,01 N концентрации раствора. Фиксаналы могут быть из различных веществ, например, в виде растворов - серная, соляная кислоты, едкий натрий, в виде сухих веществ - перманганат калия, щавелевая кислота, бура и др. Приготовление раствора проводят следующим образом: содержимое ампулы количественно переносят в мерную колбу объёмом 1л. Для этого в горло колбы вставляют воронку, вкладывают специальный стеклянный боёк, о который разбивается дно ампулы. Затем специальной стеклянной палочкой пробивается отверстие в верхней части ампулы. Содержимое ампулы выливается или высыпается в мерную колбу через воронку, затем ампула промывается сверху дистиллированной водой. После этого обмывают воронку со вставленной ампулой и удаляют. В мерной колбе раствор доводят до метки дистиллированной водой, закрывают пробкой и перемешивают. Лабораторная работа № 2
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-09-17; просмотров: 3927; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.21.12.41 (0.008 с.) |

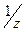 ) ∙ CN ∙ V,
) ∙ CN ∙ V,


