
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Типы окислительно-восстановительных реакций.Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
1. Реакции межмолекулярного окисления – восстановления – это реакции, в процессе которых обмен электронами происходит между разными молекулами:
2. Реакции диспропорционирования - это такие реакции, в которых молекулы или ионы одного и того же вещества реагируют друг с другом как окислитель и восстановитель вследствие того, что содержавшиеся в них атомы с промежуточной степенью окисления отдают и принимают электроны, переходя один – в состояние с низкой степенью окисления, другой – с высокой степенью окисления:
Составьте электронный баланс уравнений самостоятельно.
3. Реакции контродиспропорционирования - это реакции, обратные диспропорционированию:
4. Реакции внутримолекулярного окисления – восстановления – это реакции, в которых окислитель и восстановитель находятся в одной и той же молекуле:
Титранты оксидиметрии. Рабочими растворами в оксидиметрии являются растворы окислителей (KMnO4, К2СrO7, I2, KBrO3 и др.) и восстановителей (Na2S2O3, NaAsO2, SnCl2). Эквиваленты окислителей и восстановителей в оксидиметрии определяют делением молекулярной массы соответствующего вещества на число электронов, которые оно принимает или отдает в рассматриваемой реакции. Например:
Количественной характеристикой интенсивности окислительно- восстановительного процесса является разность окислительно-восстановительных потенциалов (выражается в вольтах) реагирующих между собой систем. Окислительно-восстановительный потенциал системы, измеренный при стандартных условиях и при величинах активностей ионов восстановленной и окисленной форм, равных единице, называют нормальным окислительно-восстановительным потенциалом системы. Зависимость окислительно-восстановительного потенциала системы от концентрации ионов восстановленной и окисленной форм выражают уравнением Нернста:
где [Oх] и [Red] - концентрации восстановленной и окисленной форм системы; n – число принимаемых или отдаваемых электронов при превращении окисленной формы в восстановленную. Если концентрации [OX]=[Red], то E=E0, т.е. окислительно-восстановительный потенциал системы будет равен ее нормальному потенциалу. Все методы оксидиметрии классифицируются в зависимости от окислителя или восстановителя, применяемых в рабочем растворе.
Метод, основанный на окислении перманганатом калия, называют перманганатометрией, на окислении бихроматом калия - хроматометрией и т.д. В оксидиметрии применяются различные методы определения точки эквивалентности: 1. исчезновение или появление окраски титранта или титруемого вещества. Например, при титровании раствором KMnO4 с концентрацией не менее 0,02М раствор окрашивается в розовый цвет при введении минимального избытка рабочего раствора (титранта); 2. окислительно-восстановительные и специфические индикаторы. Специфические индикаторы– это вещества, которые образуют интенсивно окрашенное соединение с одним из компонентов окислительно-восстановительной системы. Например, при титровании йода используют специфический индикатор – крахмал, образующий темно-синее окрашивание с молекулярным йодом – J2. Окислительно-восстановительные индикаторы – это соединения, в основном органические, способные к окислению или восстановлению, причем их окисленная и восстановленная формы имеют разную окраску (дифениламин и его производные); 3. физико-химические методы (потенциометрия) Перманганатометрия. Перманганатометрическим методом объемного анализа называют метод, основанный на окислении различных веществ перманганатом калия (KMnO4). В зависимости от условий, в которых протекает реакция окисления-восстановления, ионы MnO4‾ могут принимать различное число электронов. В кислой среде:
В нейтральной среде:
В щелочной среде:
Нормальный потенциал системы MnO4-⁄Mn2+ равен +1,52В, а MnO4-⁄MnO2 равен +0,57В, поэтому перманганат калия в кислой среде обладает сильными окислительными свойствами и способен окислять многие вещества. Эквивалент перманганата калия в кислой среде равен:
В лабораторной практике перманганат калия применяют в виде растворов различной концентрации. Обычно пользуются 0,1н раствором KMnO4, хотя в некоторых случаях применяют 0,01н, 0,05н, 0,2н растворы.
Приготовление рабочего раствора KMnO4 Перманганат калия, применяющийся для приготовления рабочего раствора KMnO4, обычно содержит ряд примесей, из которых наиболее значительными являются соединения марганца (IV). Кроме того, в первые дни после приготовления раствора происходит восстановление KMnO4 органическими примесями, содержащимися даже в дистиллированной воде. В результате концентрация раствора KMnO4 изменяется:
Поэтому сначала готовят раствор приблизительной концентрации. Например, для приготовления 500 мл 0,1н раствора KMnO4 рассчитывают необходимую навеску вещества по формуле:
m=31,608 ∙ 0,1 ∙ 0,5 ≈1,58(г) Навеску растворяют в мерной колбе объемом 0,5 л. Раствор переливают в склянку из темного стекла и оставляют в темном месте не менее чем на неделю. За это время перманганат окислит все примеси, содержащиеся в воде, а образовавшийся в результате частичного восстановления перманганат диоксид марганца MnO2 осядет на дно склянки. Раствор отфильтровывают от MnO2 и хранят в темных склянках. Очевидно, что после этого приступают к стандартизации раствора. В качестве исходных веществ для установки точной концентрации раствора KMnO4 обычно применяют оксалат аммония (NH4)2C2O4 ∙ H2O, оксалат натрия Na2C2O4 и щавелевую кислоту H2C2O4 ∙ 2H2O. Наиболее удобным является оксалат натрия, т.к. он кристаллизуется без воды и не гигроскопичен.
Реакция
является автокаталитической, поэтому для ускорения процесса раствор следует нагреть. Электродвижущую силу процесса, как разность потенциалов для этой реакции определяют вычитанием из нормального потенциала системы MnO4-/Mn2+ (E0=+1,52В) нормального потенциала системы 2CO2/C2O42- (E0= - 0,49В) Е = Е0(MnO4-/Mn2+) – Е0(2CO2/C2O42-) = +1,52 – (-0,49)= 2,01В Большая разность потенциалов показывает, что реакция необратима. Все продукты этой реакции бесцветны, тогда как раствор KMnO4 малиново-фиолетовый. Поэтому течение реакции должно сопровождаться обесцвечиванием прибавляемого раствора перманганата. Если прибавить к кислому раствору оксалата натрия 2-3 капли раствора KMnO4, бесцветный раствор окрасится в розовый цвет, что указывает на присутствие непрореагировавшего KMnO4. Окраска исчезает только через несколько минут. Это свидетельствует о небольшой вначале скорости реакции. Обесцвечивание раствора после прибавления последующих капель раствора KMnO4 происходит все быстрее и быстрее, и, наконец, будет происходить почти моментально вплоть до точки эквивалентности. Лишняя капля KMnO4 окрасит титруемый раствор в неисчезающий розовый цвет. Титрование раствором перманганата калия используют для определения множества веществ – восстановителей и окислителей (с предварительным восстановлением). Перманганатометрия – один из лучших способов определения железа в разных объектах. После растворения образца железо оказывается в степени окисления +3, поэтому его предварительно переводят в Fe2+ хлоридом олова (II) или металлами. Таким же образом с предварительным восстановлением можно определять V, Mo, W, U, Ti, Sn, Sb, которые после растворения образцов получаются в высшей степени окисления. Перманганатометрию используют для определения нитритов по реакции:
Прямое титрование невозможно: поскольку нитрит в кислой среде неустойчив, поэтому добавляют избыток перманганата и через некоторое время оттитровывают избыток стандартным раствором соли Мора. Раствор перманганата можно использовать для определения ионов, образующие малорастворимые оксалаты (Сa, Mg, Zn, Ba, Pb, Ag, Sr, Co). Перманганатометрия используется для определения общей окисляемости воды или почвы. При этом с MnO4- – ионом в кислой среде реагируют все органические компоненты.
В биохимии и в клиническом анализе методом перманганатометрии определяют содержание мочевой кислоты в моче, сахара в крови, ионы Ca2+ в кровяной сыворотке. Посредством перманганатометрии возможно определение концентрации свободных ионов Ca2+ в ротовой жидкости, от величины которой зависят процессы минерализации и реминерализации костной ткани зуба. Концентрация ионизированной формы кальция в слюне имеет важное значение для прогнозирования кариозных процессов в полости рта.
Иодометрия. Иодометрия – это титриметрический метод определения окислителей и восстановителей, основанный на реакции
Йод плохо растворим в воде, но в присутствии йодид-ионов образуется комплекс I3-, поэтому при титровании протекает реакция
Стандартные потенциалы многих восстановителей меньше Е0(I3-/3I-), а многих окислителей – выше, поэтому система служит для определения и окислителей, и восстановителей. В иодометрии наибольшее значение имеет реакция взаимодействия йода с тиосульфатом натрия, протекающая по уравнению:
Продуктом реакции является тетратионат натрия Na2S4O6 – натриевая соль тетратионовой кислоты. Йод в зависимости от концентрации окрашивает растворы от желтого до красно-бурого цвета. Для точного фиксирования точки эквивалентности в данной реакции применяют раствор крахмала, который добавляют перед концом титрования (когда раствор становиться бледно-желтым). Йод образует с крахмалом интенсивно синее соединение. В момент эквивалентности, когда восстанавливается весь йод (переходит в иозид-ионы), синяя окраска исчезает, и раствор становится бесцветным. Прямая реакция восстановления йода идет быстро, но обратная реакция окисления иодида протекает во времени. Поэтому использовать для определения окислителей раствор иодида невозможно. К тому же растворы иодидов (КI) неустойчивые, поскольку иодид окисляется кислородом воздуха. Поэтому используют косвенный прием – добавляют к окислителю избыток иодида, а выделившийся йод оттитровывают стандартным раствором тиосульфата натрия:
Непосредственное титрование тиосульфата раствором K2Cr2O7 невозможно из-за нестехиометричности реакции. Индикатором так же служит крахмал. Йодометрические определения восстановителей проводят по методу обратного титрования. К анализируемому раствору добавляют титрованный раствор йода в избытке. С определяемым веществом реагирует эквивалентное количество йода, например
Избыток йода титруют рабочим раствором тиосульфата натрия. Зная общее количество йода и непрореагировавший избыток, рассчитывают количество йода, эквивалентное анализируемому веществу. Прямое титрование сульфитов раствором йода обычно дает уменьшенные результаты, т.к. во время титрования часть сульфита окисляется кислородом воздуха
Прямая йодометрия применяется для определения As (III), Sn (II), Sb (III), сульфитов, сульфидов, тиосульфатов, аскорбиновой кислоты и др., косвенная – для определения Cu (II), O2, H2O2, броматов, иодатов, гипохлоритов В биохимии и клиническом анализе методом йодометрии определяют содержание альдегидной и кетонной группы, ацетона, хинона, гидрохинона, антипирина и др.
Лабораторный практикум. Работа 1. Установление нормальности и титра KMnO4 по 0,05н раствору щавелевой кислоты.
Нормальность и титр KMnO4устанавливают по щавелевой кислоте. В основе процесса титрования лежит реакция между KMnO4 и H2C2O4 H2O в кислой среде:
Ход определения Бюретку заполняют раствором KMnO4. Кончик бюретки должен быть полностью заполнен раствором перманганата. В коническую колбу для титрования с помощью пипетки вносят 5 мл раствора щавелевой кислоты H2C2O4. Добавляют 2-2,5 мл 2н раствора H2SO4 и нагревают на водяной бане до 70o-80oC, не допуская кипения раствора. Горячий раствор титруют перманганатом калия, добавляя его по каплям и непрерывно перемешивая. Первые капли KMnO4 обесцвечиваются не сразу. Пока не произошло обесцвечивание, не рекомендуется приливать последующие капли. Титрование прекращают, когда прибавление очередной капли раствора KMnO4 вызывает уже неисчезающую розовую окраску содержимого колбы в течение 1-2 минут. Объем KMnO4, затраченный на титрование отмечают на бюретке по верхнему мениску. Титрование повторяют 3 раза и данные записывают в таблицу.
Таблица 7.
Нормальность и титр раствора перманганата калия вычисляют, исходя из среднего объема раствора KMnO4, затраченного на титрование
|
||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-09-17; просмотров: 1260; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.218.63.176 (0.011 с.) |



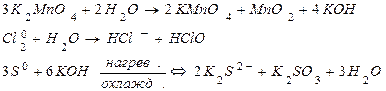








 (г/моль)
(г/моль)














